В настоящее время описаны два аллотропических видоизменения бора: аморфный бор (белый порошок без запаха и вкуса, плохо проводит тепло и электрический ток) и кристаллический бор – гранатово-красные кристаллы квадратной системы, хрупкие и твердые.
Пока точно не установлено, сколько аллотропных видоизменений образует бор.
Химические свойства:
Бор обладает и свойствами восстановителя, и свойствами окислителя, напоминая С и особенно кремний.
1) При нагревании 4B + 3 O2 = 2 B2O3
2) Концентрированные H2SO4 и HNO3 окисляют бор до борной кислоты:
B + 3 HNO3 = H3BO3 + 3 NO2↑
0 - 3ē +3
 1 B0 + 3 H2O → H3BO3 + 3 H+
1 B0 + 3 H2O → H3BO3 + 3 H+
+1 +1ē 0
 NO3- + 2H+ → NO20 + H2O0
NO3- + 2H+ → NO20 + H2O0
B + 3 H2O + 3 NO3- + 6 H+ → H3BO3 + 3 H+ + 3 NO2 + 3 H2O
3 1
4) При высокой температуре взаимодействует с металлами, водой, с крепкими растворами щелочей.
Выводы:
1.Бор и алюминий – элементы главной подгруппы третьей группы.
2.Внешние электронные оболочки содержат 3 электрона, из которых два спаренных s-электрона и один p-электрон.
3. При возбуждении один из s-электронов переходит в свободную p-ячейку, то есть на внешней оболочке электроны становятся неспаренными. Такое состояние отвечает валентности 3, а в соединениях проявляется степень окисления +3.
4.Бор в соединениях проявляет валентность, равную трем, или ковалентность, равную четырем.
5.Алюминий является металлом менее активным, чем стоящие левее магний и натрий. По свойствам напоминает бериллий.
6.В природе бор встречается в основном в виде борной кислоты H3BO3 и солей борных кислот (например, буры Na2B4O7 * 10 H2O).
7.Бор – микроэлемент, содержащийся в незначительных количествах в животных и растительных организмах.
Предполагают, что бор усиливает действие инсулина, тормозит окисление адреналина.
8.В настоящее время описаны два аллотропических видоизменения бора: аморфный бор и кристаллический бор
9.Бор обладает и свойствами восстановителя, и свойствами окислителя, напоминая С и особенно кремний.
| 10.Соединения бора: оксид;борные кислоты и их соли. Качественные реакции на борат-, тетраборат-ионы. |
Оксид бора – B2O3 – стекловидная масса, растворяется в воде с образованием борной кислоты:
B2O3 + 3 H2O → 2 H3BO3
Борная кислота – бесцветные, блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок.
Растворима в холодной (1:25) и легко кипящей воде (1:4), растворима в спирте (1:25). Водные растворы имеют слабокислую реакцию.
Борная кислота относится к слабым кислотам, слабее угольной и сероводородной. При нагревании теряет воду:
4 HBO2
H3BO3 → HBO2 → H2B4O7 → 2 B2O3
- H2O - H2O - H2O
ортоборная метаборная тетраборная
кислоты: устойчивая малоустойчивая неустойчивая
соли: неустойчивые малоустойчивые устойчивые
Борная кислота реагирует со щелочами:
4 H3BO3 + 2 NaOH → Na2B4O7 + 7 H2O
тетраборат натрия
(бура)
Соли борных кислот называются боратами.
Тетраборат натрия. Бура.
Бесцветные, прозрачные, легко выветривающиеся кристаллы или белый, кристаллический порошок. Растворим в воде (1:25 в холодной и 2:1 в кипящей), глицерине, нерастворим в спирте.
Водные растворы имеют солоновато-щелочной вкус и щелочную реакцию (вследствие гидролиза).
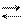 Na2B4O7 2 Na+ + B4O72- слаб.
Na2B4O7 2 Na+ + B4O72- слаб.
 Na2B4O7 NaOH (с.)
Na2B4O7 NaOH (с.)
 H2B4O7 (сл.)
H2B4O7 (сл.)
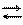 B4O72- + 7 HOH 4 H3BO3 + 2 OH-, pH > 7
B4O72- + 7 HOH 4 H3BO3 + 2 OH-, pH > 7
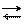 Na2B4O7 + 7 HOH 4 H3BO3 + 2 NaOH
Na2B4O7 + 7 HOH 4 H3BO3 + 2 NaOH
Бура используется для получения борной кислоты:
Na2B4O7 + H2SO4 + 5 H2O = 4 H3BO3 + Na2SO4
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА БОРАТ-ИОН: образование борно-этилового эфира.
Техника выполнения: в выпарительную чашку поместить 0, 2 кристаллической борной кислоты, добавьте 2 мл этилового спирта и 1 мл концентрированной серной кислоты (катализатор и водоотнимающее средство), поджечь. Образовавшийся борно-этиловый эфир горит пламенем с зеленой каймой.

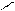
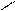 OH HO – C2H5 H2SO4 (к) O – C2H5
OH HO – C2H5 H2SO4 (к) O – C2H5
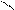

 B – OH + HO – C2H5 B – O – C2H5 + 3 H2O
B – OH + HO – C2H5 B – O – C2H5 + 3 H2O
OH HO – C2H5 O – C2H5
борно-этиловый эфир
(пламя с зеленой каймой)
Выводы:
1.Оксид бора – B2O3 – стекловидная масса, растворяется в воде с образованием борной кислоты.
2..Борная кислота относится к слабым кислотам, слабее угольной и сероводородной. При нагревании теряет воду.
3.Соли борных кислот называются боратами.
4..Водные растворы буры имеют солоновато-щелочной вкус и щелочную реакцию (вследствие гидролиза).
5.КАЧЕСТВЕННАЯ РЕАКЦИЯ НА БОРАТ-ИОН: образование борно-этилового эфира.
Это реакция взаимодействия борной кислоты или тетрабората натрия с этиловым спиртом в присутствии конц.серной кислоты.
Поджечь. Образовавшийся борно-этиловый эфир горит пламенем с зеленой каймой.
11.Применение соединений бора в медицине и народном хозяйстве.
а) Кислота борная – обладает антисептической активностью. При местном применении (в виде мази) оказывает также антипедикулезное действие.
Применяют кислоту борную у взрослых.
Назначают в виде 2 % водного раствора для промывания конъюнктивального мешка при конъюнктивитах; 3 % раствором пользуются для примочек при мокнущей экземе, дерматитах.
Спиртовыми растворами 0, 5 %, 1 %, 2 %, 3 % и 5 % используются в виде капель при остром и хроническом отите, а также для обработки пораженных участков кожи при пиодермии, экземе, опрелостях.
Раствор 10 % в глицерине применяют для смазывания пораженных участков кожи при опрелостях, а также кольпитах. Для лечения педикулеза применяют 5% борную мазь.
Применение борной кислоты противопоказано больным с нарушениями функции почек, кормящим матерям для обработки молочных желез, детям (в т.ч. новорожденным), беременным и лицам с индивидуальной непереносимостью. Не следует препараты борной кислоты наносить на обширные поверхности тела.
б) Натрия тетраборат. Применяют наружно как антисептическое средство у взрослых для полосканий, смазывания кожи (при опрелостях, пролежнях), спринцеваний. Имеется также раствор натрия тетрабората 20 % в глицерине.
в) Таблетки «Бикарминт» (натрия тетраборат и натрия гидрокарбонат по 0, 4, натрия хлорид 0, 2, ментол 0, 002, масло мятное 0, 004).
Применяют как антисептическое и противовоспалительное средство для полосканий, промываний, ингаляций при воспалительных заболеваниях верхних дыхательных путей.
г) Линимент борно-цинковый (H3BO3 + ZnO + масло подсолнечное). Применяют наружно как антисептическое и подсушивающее.
д) Паста борно-цинко-нафталанная (H3BO3 + ZnO + крахмал + мазь нафталанная).
е) Применяется в качестве местного антисептического и обезболивающего средства (при невралгиях, миозитах) раствор, содержащий кислоты борной 3 г, новокаина 2 г, спирта этилового 70 % до 100 мл.
ж) «Бороментол» - мазь состава: ментола 0, 5 части, борной кислоты 5 частей, вазелина 94, 5 части.
Применяют как антисептическое и болеутоляющее средство для смазывания кожи при зуде, невралгии, а также для смазывания слизистой оболочки носа при ринитах.
Выводы:
а) Кислота борная – обладает антисептической активностью.
б) Натрия тетраборат. Применяют наружно как антисептическое средство.
в) Таблетки «Бикарминт» (натрия тетраборат и натрия гидрокарбонат по 0, 4, натрия хлорид 0, 2, ментол 0, 002, масло мятное 0, 004).
Применяют как антисептическое и противовоспалительное средство.
г) Линимент борно-цинковый (H3BO3 + ZnO + масло подсолнечное). Применяют наружно как антисептическое и подсушивающее.
д) «Бороментол» - мазь. Применяют как антисептическое и болеутоляющее средство
| 12.Характеристика алюминия, исходя из его положения в ПСХЭ им. Д.И. Менделеева,с точки зрения теории строения атома,степени окисления. Бор и алюминий – элементы главной подгруппы третьей группы. Их электронная конфигурация: бора: 1s22s22p1 алюминия: 1s22s22p63s23p1 Внешние электронные оболочки содержат 3 электрона, из которых два спаренных s-электрона и один p-электрон. Следовательно, в нормальном, невозбужденном состоянии должны проявлять валентность 1, что соответствует степени окисления в соединениях +1. Но, соединения, где бор и алюминий проявляют степень окисления +1 неустойчивы. При возбуждении один из s-электронов переходит в свободную p-ячейку, то есть на внешней оболочке электроны становятся неспаренными. Такое состояние отвечает валентности 3, а в соединениях проявляется степень окисления +3. Алюминий. При движении вдоль периода от натрия к магнию и затем к алюминию заряд ядра растет, а радиус атома уменьшается. В соответствии с этим увеличивается энергия ионизации и уменьшается металличность элементов. Поэтому алюминий является металлом менее активным, чем стоящие левее магний и натрий. По свойствам напоминает бериллий. Выводы: |
| 1.Бор и алюминий – элементы главной подгруппы третьей группы. 2.Их электронная конфигурация: бора: 1s22s22p1 алюминия: 1s22s22p63s23p1 3.При возбуждении один из s-электронов переходит в свободную p-ячейку, то есть на внешней оболочке электроны становятся неспаренными. Такое состояние отвечает валентности 3, а в соединениях проявляется степень окисления +3. 4.Алюминий является металлом менее активным, чем стоящие левее магний и натрий. По свойствам напоминает бериллий. |
13.Алюминий: распространение в природе, биологическая роль, получение, физические и химические свойства.
В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает 1-ое место среди металлов и 3-ье среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет около 9 % по массе.
Важнейшие природные соединения алюминия:
а) Алюмосиликаты – соли, образованные оксидами алюминия, кремния, щелочных и щелочно-земельных металлов. Они и составляют основную массу земной коры. Продукты их выветривания – глина и полевые шпаты.
б) Боксит – горная порода, из которой получают алюминий. Она содержит оксид алюминия Al2O3.
в) Корунд – минерал состава Al2O3, обладает очень высокой твердостью, поэтому его мелкозернистая разновидность, содержащая большое количество примесей, - наждак, применяется как абразивный (шлифовочный) материал.
г) Эту же формулу имеет и другое природное соединение – глинозем.
д) Хорошо известны прозрачные кристаллы корунда: красные рубины, синие – сапфиры, которые используют как драгоценные камни.






