К.ч. 6 Þ октаэдрическое расщепление 5d- орбиталей.

Е:Br-:Br- :Br- :Br- :Br-:Br-
 |
5 dg
S 6p
5 d 5 de

D2sp3 – гибридизация
Структура комплекса - октаэдр
● комплекс - внутриорбитальный,
устойчивый, т.к. участвуют внутренние 5dg-
Орбитали
● комплекс - низкоспиновый, диамагнетик,
Т.к. нет неспаренных электронов.

· Если комплексообразователь 3 d – элемент Þ лиганды слабого поля Þ тетраэдрическое расщепление.
· Если комплексообразователь 4 d - или 5 d - элементы Þ лиганды сильного поля Þ плоско-квадратное расщепление.
 |
■ Комплексообразователь Au3+: 5 d 86 s 0.
К.ч. 4
■ комплексообразователь 5 d - элемент Þ лиганды сильного поля Þ плоско-квадратное расщепление

|
 Е
Е
5 d
6s 6 p
Dsp2- гибридизации орбиталей
● комплекс - низкоспиновый,
Диамагнетик (нет неспаренных электронов).

■ комплексообразователь Ni2+: 3 d8 4 s2
■ К.ч. 4
■ комплексообразователь - 3 d - элемент
■ лиганды Þ слабого поля
■ тетраэдрическое расщепление d - орбиталей


 : Cl: Cl: Cl: Cl
: Cl: Cl: Cl: Cl





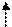









 Е
Е
 3 de
3 de












 4 s 4 p
4 s 4 p







 3 dg
3 dg
Sp3-гибридизация АО
Структура - тетраэдр
● комплекс - высокоспиновый, непрочный,
Парамагнетик, т.к. есть неспаренные электроны на 3de - орбиталях
Таблица. Структура комплексов в зависимости
От вида гибридизации
| К.ч. | компл- обр-ль | лиганды | Гибридизация орбиталей | Структура комплекса |
| любой | Sp | линейная | ||
| 3 d -элемент | все слабого поля | d3s, d2sp, sp3 | тетраэдр | |
| 4 d, 5 d -элемент | все сильного поля | dsp2 | плоский квадрат | |
| любой | d2sp3, sp3d2, dsp3d | октаэдр |

(ученик, стр.81)
Т.к. разность энергии (D) между dg - и de -орбиталями небольшая, возможен переход электрона с более низкого на более высокий уровень энергии за счет поглощения видимого света. Этот переход является причиной определенной окраски комплекса,
т.е. окраска зависит от того, фотоны какой длины волны могут этим комплексом поглощаться.
При этом энергия кванта света должна быть точно равна энергии расщепления D, т.е. h×n=D. Зная длину волны света (l=c/n), соответствующую окраске комплекса, можно рассчитать для того или иного лиганда D=ch/l.
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду левее (т. е. обладающие большей силой поля), значение D возрастает, и комплекс начинает поглощать лучи света с меньшей длиной волны. Это сказывается на изменении его окраски. Например,
(Со(ONO)(NH3)5)2+- красный
(Co(NO2)(NH3)5)2+ - желтый
CuCl4)2- - зеленый
(Cu(H2O)4)2+ - голубой
(Cu(NH3)4)2+ - сине-фиолетовый
Для большинства двухзарядных комплексообразователей энергия расщепления
D отвечает n в пределах от 8000 до 14000 см-1, что соответствует энергии от 95 до 140 кДж/моль.
Видимый спектр имеет следующие длины волн (нм):
Фиолетовый 400 – 420 желтый 575 – 585
Голубой 424 – 490 оранжевый 585 – 647







