Пример. Составьте схемы электролиза водных растворов солей:
а) K2SO4 с инертными электродами.
б) FeCl3 с железным анодом.
Напишите электронные уравнения катодных и анодных процессов и суммарные уравнения электролиза. Ответ обоснуйте.
Решение.
При электролизе растворов солей:
На катоде (-) в первую очередь восстанавливаются те ионы (атомы молекулы), потенциалы которых наиболее высокие (см. таблицу25).
Активные металлы от Li до Al не разряжаются на катоде, т.к. имеют более отрицательное значение электродных потенциалов, чем водород. В этом случае будет восстанавливаться H+ из воды. Если электродный потенциал металла более положителен, чем водородный потенциал (металлы стоящие в ряду напряжений после водорода) на катоде разряжаются ионы металла. Если электродный потенциал металла не ниже (-1), то могут восстанавливаться на катоде металлы (от Zn до H).
На аноде (+) будут разряжаться (окисляться) ионы (атомы, молекулы), потенциалы которых в данных условиях наиболее низкие (табл.25).
1) На нерастворимых анодах окисляются анионы бескислородных кислот: S-2, I-, Br–, Cl-.
2) Кислородсодержащие анионы (SO42-, NO3-, SO32- и F-) не разряжаются. В этом случае окисляются анионы OH- из воды.
3)На металлических (растворимых) анодах разрушается материал самого анода, т.к. электродный потенциал металла более отрицательный по сравнению с потенциалом H- и других анионов.
Схемы процесса электролиза солей:
 а)
а) 
 –K
–K
H2
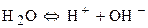
Процесс восстановления:

Побочный процесс:

+А
O2
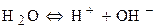

Процесс окисления:
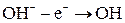


Побочный процесс:

Суммарное уравнение процесса электролиза:

Т.е. при электролизе раствора соли, образованной активным металлом и кислородсодержащим анионом, происходит электрохимическое разложение воды.
б) 
–K
|

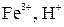
Процесс восстановления:


+А
|


Процесс окисления:

 |
При электролизе растворов с металлическим анодом окисляется материал анода, т.к. имеет меньшее значение электродного потенциала.
Контрольные задания
При выполнении контрольных заданий используйте таблицу 25
261. В растворе содержатся ионы Аg+, Ni2+, Sn2+, Сu2+ (концентрация одинакова). В какой последовательности будут восстанавливаться они при электролизе с инертными электродами. Ответ обоснуйте. Для никелирования детали из какого материала следует изготовить анод? Составьте схему электролиза раствора соли NiSO4 с никелевым анодом, напишите электронные уравнения для процессов, протекающих на катоде и аноде.
262. В какой последовательности будут разряжаться ионы при электролизе раствора, содержащего ионы Аg+, Fe2+, Pb2+, Сu2+ одинаковой концентрации и напряжении тока, достаточном для выделения любого металла. Ответ обоснуйте. Составьте схему электролиза раствора соли Рb(NОз)2 с инертными электродами, напишите электронные уравнения для процессов протекающих на катоде и аноде.
263. Электролит содержит смесь хлоридов LiС1, СаС12, NaС1, ВаС12, КСl. Какие элементы должны быть удалены из расплава этих солей перед проведением электрохимического выделения кальция? Ответ обоснуйте. Составьте схему электролиза расплава и раствора хлорида кальция с инертными электродами, напишите электронные уравнения для процессов, протекающих на катоде и аноде.
264. В какой последовательности будут разряжаться ионы Pb2+, Hg2+ Bi3+, Со2+ (концентрация одинаковая) при электролизе растворов нитратов соответствующих солей? Ответ обоснуйте. Составьте схему электролиза раствора соли Со(NO3)2; с инертными электродами и с растворимым кобальтовым анодом, напишите электронные уравнения для процессов, проходящих на катоде и аноде.
265. Чем отличается электролиз водных растворов электролитов от электролиза их расплавов? Какие ионы и молекулы, находящиеся в водных растворах солей, могут восстанавливаться на катоде и окисляться на аноде? Составьте схемы электролиза расплава и раствора соли NaIс инертными электродами, напишите электронные уравнения для процессов, проходящих на катоде и аноде. Увеличится или уменьшится значение рН в прикатодном пространстве при электролизе раствора соли NaI? Ответ обоснуйте.
266. При электролизе водного раствора соли значение рН в приэлек-тродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу: а) КС1; б) СuС12; в) Сu(NО3)2
Ответ обоснуйте. Составьте схему электролиза раствора этой соли с инертными электродами, напишите электронные уравнения для процессов протекающих на катоде и аноде.
267. При электролизе водного раствора сульфата никеля (II) на аноде протекает реакция: 2Н2О = О2+ 4Н+ + 4e–.Из какого материала сделан анод: а) никеля; б) меди; в) золота? Ответ обоснуйте. Составьте схему электролиза раствора указанной соли с выбранным анодом, напишите электронные уравнения для процессов, протекающих на катоде и аноде.
268. В какой последовательности должны разряжаться ионы Аg+, Fe2+, Сu2+,Вi3+, Мn2+ при электролизе растворов сульфатов соответствующих металлов? Ответ обоснуйте. Составьте схемы электролиза раствора сульфата марганца (II), если электроды угольные. Напишите электродные уравнения для процессов, протекающихна катоде и аноде.
269. Напишите схему процесса электролиза водного раствора сульфата меди и рассчитайте объем кислорода (н.у.), выделившегося на аноде, если за то же время выделилось 0,381 г меди.
270. При электролизе водного раствора соли с угольными электродами значение рН в пространстве одного из электродов понизилось. Раствор какой соли подвергся электролизу: а) СuCl2 б) KCl в) Сu(NO3)2. Ответ обоснуйте. Составьте схему электролиза раствора этой соли, напишите электронные уравнения для процессов, проходящих на катоде и аноде.
271. В растворе содержатся ионы Sr2+, Ba2+, Al3+, Cr3+(концентрация одинакова). В какой последовательности будут разряжаться они при электролизе водных растворов нитратов соответствующих солей? Ответ обоснуйте. Составьте схему электролиза раствора Al(NO3)3 с инертным анодом. Напишите электронные уравнения для процессов, проходящих на катоде и аноде.
272. Что называют анодным растворением металла и при каких условиях возможен этот процесс? Сравните металлы кадмий, медь и золото в отношении их возможности функционировать в качестве растворимого анода. Ответ обоснуйте. Составьте схему электролиза водного раствора хлорида меди с медным электродом, напишите уравнения для процессов, проходящих на катоде и аноде, и суммарные уравнения электролиза.
273. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди? Ответ обоснуйте. Составьте схему электролиза водного раствора сульфата никеля, если анод угольный. Напишите электронные уравнения для процессов, проходящих на катоде и аноде, и суммарное уравнение процесса электролиза.
274. Какой процесс будет протекать при электролизе раствора хлорида висмута с висмутовым и угольным анодом? Ответ обоснуйте. Составьте схему электролиза этой соли с анодом из материала висмута, напишите электронные уравнения для процессов, протекающих на катоде и аноде, а также суммарное уравнение электролиза соли.
275. Какие газообразные вещества образуются при электролизе раствора солей хлорида и сульфата магния (электроды угольные)? Ответ обоснуйте. Составьте схемы электролиза растворов этих солей с инертными электродами, напишите электронные уравнения для процессов, протекающих на катоде и аноде, и суммарные уравнения электролиза этих солей. Как изменится значение рН в прианодном пространстве при электролизе растворов этих солей?
276. Какими катодными процессами характеризуется электролиз водных растворов солей металлов, стоящих в начале ряда напряжений и в средней его части? Чем это определяется? Рассмотрите на примерах раствора солей NaCl и ZnCl2. Составьте схему электролиза раствора хлорида цинка на угольном аноде. Напишите электронные уравнения для процессов, протекающих на аноде и катоде.
277. При электролизе водного раствора нитрата никеля (II) на аноде протекает реакция 2Н2О = О2+ 4Н+ + 4е-. Из какого материала сделан анод:
а) никель; б) висмут; в) платина. Ответ обоснуйте. Составьте схему электролиза раствора указанной соли с выбранным анодом, напишите электронные уравнения для процессов, протекающих на катоде и аноде, и суммарное уравнение электролиза этой соли.
278. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации ионы Ba2+, Mn2+, Fe3+, Au3+? Ответ обоснуйте. При электролизе водного раствора одной из солей значение рН в приэлектродном пространстве возросло. Раствор какой соли подвергся электролизу: а) ВаС12; б) FеС13; в) АuСl3? Почему? Составьте схему электролиза раствора этой соли с платиновыми электродами, напишите электронные уравнения электродных процессов и суммарное уравнение электролиза соли.
279. Cоставьте схему электролиза расплава и раствора йодида бария с угольными электродами. Напишите электронные уравнения электродных процессов и суммарные уравнения электролиза соли.
280. Чем отличается электролиз водных растворов электролитов от электролиза их расплавов? Какие ионы и молекулы, находящиеся в водных растворах солей, могут восстанавливаться на катоде и окисляться на аноде? Каким методом можно получить чистый калий и раствор КОН из соли КСl? Напишите электронные уравнения электродных процессов и суммарные уравнения электролиза соли.
Тема 11. Органические соединения и полимеры
Задания 281 – 300 (таблица 14)
Контрольные задания
Для каждого из веществ, данных в Вашем варианте, выполните следующее:
– укажите классы, к которым они относятся
– изобразите их полные структурные формулы и дайте им названия по международной систематической номенклатуре
– обозначьте имеющиеся связи в данных соединениях символами σ и π
– напишите уравнения типичных реакций этих веществ с указанием их условий, дайте названия продуктов реакций
Укажите, какое из веществ, данных в Вашем варианте, является мономером и для какого из процессов – полимеризация или поликонденсация. Напишите схему реакции полимеризации или поликонденсации этого вещества. При необходимости для его поликонденсации подберите самостоятельно второй мономер. Укажите класс полученного полимера и возможные направления его использования, в том числе в Вашей будущей отрасли. Дайте определения: что такое полимер, мономер, реакции полимеризации и поликонденсации.
Таблица 15
| Задания | Соединения | |
| CH2=CH–CH3; | C2H5OH | |
| CH2 =C(CH3)–CH=CH2; | CH3CHO | |
| C2H4; | CH3COOH | |
| C2H2; | CH3COCH3 | |
| CH2=C(Cl)-CH=CH2; | C6H5OH | |
| циклогексан; | CH3COOCH=CH2 | |
| C6H5CH3; | C2H4(OH)2 | |
| C3H4; | C6H5NH2 | |
| CH2=CH-C2H5; | C2H5CHO | |
| CH3CH2CH3; | C3H5(OH)3 | |
| C6H5C2H5; | CH2=CHCN | |
| CH2=CH-CH=CH2; | CH3CO-C2H5 | |
| C4H8; | n-C6H4(COOH)2 | |
| стирол; | C6H5CHO | |
| CH2=CCl2; | C6H5CH2OH | |
| C4H10; | CH2=CHCONH2 | |
| C5H12; | NH2CH2COOH | |
| C6H6; | HOCH2COOH | |
| C5H10; | C2H5COOC2H5 | |
| CH3C(CH3)2CH3; | CF2=CF2 |
Темы лабораторных работ
Тема: ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ И ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ






