Особливості будови і міцність зв’язку Cl-O в оксоаніонах Таблиця №7. Назви оксикислот хлору
| Формула кислоти | Тривіальна назва | Сучасна назва | ||
| кислоти | кислотного залишку | кислоти | кислотного залишку | |
| HClO | хлорнуватиста | гіпохлорит | хлоратна (І), оксохлоратна | хлорат (І), оксохлорат |
| HClO2 | хлориста | Хлорит | хлоратна (ІІ), діоксохлоратна | хлорат (ІІ), діоксохлорат |
| HClO3 | хлорнувата | Хлорат | хлоратна (ІІІ), триоксохлоратна | хлорат (ІІІ), триоксохлорат |
| HClO4 | хлорна | Перхлорат | хлоратна (ІV), тетраоксохлоратна | хлорат (ІV), тетраоксохлорат |
У водних розчинах оксокислоти хлору дисоціюють, більшість із них відомі тільки в розчинах, тому, за винятком слабкої HClO, має сенс порівнювати будову (будову газоподібної HClO4 установлено електронографічно: атоми оксигену розташовані у вершинах викривленого тетраедра) і властивості оксоаніонів. В ряду HClO-HClO2--HClO3 - HClO4 просторова будова аніонів змінюється (табл.8) від лінійної у випадку ClO- дотетраедричної в ClO4-.
Таблиця 8. Будова і властивості оксокислот хлору
| Формула кислоти | HclO | HClO2 | HClO3 | HClO4 | |||
Довжина зв’язку Cl-O, 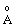
| 1.71 | 1.64 | 1.57 | 1.45 | |||
| Кути |  HOCl= 113o HOCl= 113o
|  OСlO =110,5 OСlO =110,5
|  OClO= 107o OClO= 107o
|  OClO= 105.6o OClO= 105.6o
| |||
| Eзв. Cl-O, кДж/моль | 209.0 | 244.5 | 243.7 | 363 | |||
| рКa 25оС | 7.5 | 2.0 | -1.2 | -10 | |||
Ео, B 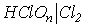
| 1.63 | 1.63 | 1.47 | 1.34 | |||

| 
| 
| 
| ||||
Слід відзначити зменшення міжатомної відстані і зростання енергії зв’язку Cl-O в аніонах по мірі зростання в них числа атімов оксигену. З позиції метода МО ЛКАО це пов’язано з збільшенням числа електронів на зв’язуючих молекулярных орбиталях. З точки зору метода валентних зв’язківй (МВЗ), підвищення міцності зв’язку Cl-O в ряду HClO- 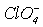 може бути пов’язано із зростанням зв’язування за рахунок вакантних
може бути пов’язано із зростанням зв’язування за рахунок вакантних  ,
,  -орбіталей хлора і електронів 2рх - і 2рy -орбіталей оксигену, які не приймають участі в утворенні
-орбіталей хлора і електронів 2рх - і 2рy -орбіталей оксигену, які не приймають участі в утворенні  -зв’язків.
-зв’язків.
Кислотні властивості. Індукційний ефект
Із співставлення величин рКa, наведених в табл.7, видно, що легкість відщеплення протона в оксокислотах зменьшується в ряду HClO4>HClO3>HClO2>HClO. Правила, що характеризують силу оксокислот, сформульовані Л.Полінгом. Перше правило: величина першої константи дисоціації оксокислот (HO)nXOm визначається числом m кінцевих, негідроксильних атомів оксигену. Величину константи дисоціації pK1 = = -lgK1 для кислот (HO)nXOm можна оцінити за рівнянням рК1 = 8-5m. Це правило якісно пояснюють так званим індукційнмм ефектом. Індукційний ефект полягає в тому, що більш електронегативний кінцевий (негідроксильний) атом оксигену відтягує на себе електронну густину від атома хлора. Атом хлора із збільшеним позитивним зарядом, в свою чергу, відтягує електрони від атома оксигена гідроксильної групи. Таким чином, кінцевий атом оксигену знижує електронну густину на зв’язку Н-О, ослаблює ї и, тим самим, збільшує легкість відщеплення протона молекулами води.
По мірі переходу від HClO до HClO4 число кінцевих атомів оксигену і індукційний ефект збільшуються, а сила кислот, відповідно, зростає.
Друге правило Полінга стосується величин констант дисоціації багатоосновних кислот (HO)nXOm, де n> 1: послідовність констант дисоціації К1, К2, К3, ј знаходяться у відношенні 1:10-5:10-10. Це правило є емпіричним, а зменшення величин констант дисоціації зумовлено зростанням заряду аніона.
Стабильность оксокислот хлора и их солей.
Більшість оксокислот галогенів існує тільки у водних розчинах. Хімічні властивості кислот і їх солей визначаються стабільністю, чи стійкістю, аніонів в кислих, нейтральних і лужних середовищах.
Оксигеновмісні кислоти хлора HClO, HClO2, HClO3 при рН=0 термодинамічно нестабільні і диспропорціонують за реакціям
3HClO = HClO3 + 2HCl (1),
3HClO2 = 2HClO3 + HCl (2),
4HClO3 = 3 HClO4 + HCl (3).
Оскільки Е3>Е2>Е1, то термодинамічна стабільність зменшується в ряду HClO - HClO2 - HClO3.
Можливий перебіг і таких реакцій
5HClO = 2Cl2 + HClO3 +2H2O (4)
7HClO3 = Cl2 + 5HClO4 + H2O (5).
Крім того, потенціал відновлення кисню
O2 + 4H+ + 4e = 2H2O (6)
(Е0=1,23 В) при рН = 0 и р(О2)=1 атм менший за потенціали реакцій (1)-(5), тому можливо, що, наприклад, HClO буде окиснювати воду з виділенням кисню а рівняння реакції (7) не важко отримати комбінуванням реакцій

HClO = HCl + 1/2O2 (7).
При рН=0 найбільш стійкими формами є HClO4 і Cl2, оскільки вони є кінцевими продуктами всіх реакцій диспропорціонування (1-5).
В лужному середовищі потенціали і енергії Гіббса напівреакцій, що включають іони гідрогену, зменшуються. Солі оксокислот тому стають стабільніше, ніж самі кислоти. Кінцевими продуктами розпаду будуть хлориди і перхлорати.
Розглянемо кінетичну стабільність оксокислот і їх солей, тобто швидкість реакцій (1-5, 7). Вона визначається трьома факторами:
1.
ростом енергії зв’язку Cl-O в ряду HClO–HClO2 –HClO3 – HClO4;
1.
збільшенням екранування атома хлору атомами оксигену, тобто зменшенням його доступності до взаємодії з іншими атомами (чи їх угрупуваннями);
2.
трудністю зародження газової фази в рідкому розчині.
Фактори 1 і 2 підвищують енергію активації і уповільнюють швидкість реакції (1-3) в ряду HClO>HClO2>HClO3, так oо на найповільнішою стає реакція (3). Кінетично нестійкими) будуть кислоть HClO і HClO2, а нацбільш інертною - хлорновата кислота HClO3. Одержати у розчині хлорну кислоту HClO4 шляхом диспропорціонування HClO3 неможливо через кінетичні причини. Фактор 3 приводить до того, що процеси (4,5,7) стають загальмованими, оскільки гетерогенні реакції, що супроводжуються виділенням хлору і кисню, перебігають значно повільніше, ніж гомогенні реакції диспропорціонування.
В цілому, всі оксокислоти хлору термодинамічно і кінетично нестабільні. Солі оксокислот хлору, навпаки, термодинамічно і кінетично більш стійкі. Це пов’язано з тим, що тверді солі побудовані із іонів, електростатична взаємодія яких підвищує енергію кристалічної ґратки і, відповідно, стабільність.
Окиснювальна здатність оксокислот хлора
Окиснювальна здатність оксокислот хлору пов’язана з можливістю пониження ступені окиснення в аніоні кислоти HXOn, n = 1,2,3,4.
1.Всі oксокислоти є сильними окисниками.
2.Їх окисна здатність відповідає такій послідовності: Cl2 < HClO 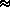 HClO2 >HClO3 > HClO4.
HClO2 >HClO3 > HClO4.
Наприклад, розчин солі NaClO окиснює  до Br2 в кислому, нейтральному та лужному середовищах:
до Br2 в кислому, нейтральному та лужному середовищах:
NaClO + 2KBr + H2O = NaCl +Br2 +2KOH ( в лужному середовищу відбувається подальше окиснення Br2 до  ).
).
За допомогою NaClO3  окиснює тільки в кислому середовищу:
окиснює тільки в кислому середовищу:
NaClO3+ 6KBr +3H2SO4 = 3Br2 + NaCl + 3K2SO4 + 3Н2О.
3.Із зростанням рН = -lg[H+] окиснювальна здатність зменшується. Наприклад, для реакції


у відповідності до рівняння Нернста
 .
.
величина потенціалу зменшується від Ео = 1.02 В при рН= 0 до Ео = +0.37при рН=14. Таким чином, окиснювальна здатність солей нижче, ніж відповідних кислот.
Оксокислоти HXO та їх солі
Гіпогалогенітні кислоти HXO відомі лише в розбавлених водних розчинах. Їх одержують взаємодією галогена з суспензією оксида ртуті:
2X2 + 2HgO + H2O = HgO. HgХ2  +2HOX.
+2HOX.
Слід відзначити особливість сполуки HOF. Вона утворюється при пропусканні фтора над кригою при -400С і конденсацією утвореного газу при температурі нижче 0оС.
F2,газ + H2Oлед 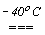 HOF + HF
HOF + HF
HOF не утворює солей, а при її взаємодії з водою з’являється гідроген пероксид:
HOF + H2O = H2O2 + HF
Гіпогалогенітні кислоті є слабкими. При переході від хлору до йоду по мірі зростання радіуса і зменшення електронегативності атом галогену слабкіше зміщує електронну густину від атома оксигена и, тим самим, слабкіше поляризує зв’язок Н-О. В наслідок чого кислотні властивості в ряду HClO - HBrO - HIO послаблюються (див. величини рКa в табл.9).
Таблиця 9. Властивості кислот HXO та йонів ХО-
| Властивості | HOCl | HOBr | HOI |
Eo,B (pH=0): HOХ+H++ 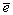 =1/2Х2+H2O =1/2Х2+H2O
| 1.63 | 1.59 | 1.45 |
Eo,B (pH=14): 
| 0.94 | 0.76 | 0.49 |
pKа процесу 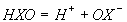
| 7.25 | 8.7 | 11 |
Константа рівноваги 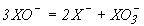
| 1027 | 1015 | 1020 |
Розчини гіпогалогенітів мають сильно лужну реакцію, а пропускання через них СО2 приводить до утворення кислоти, наприклад,
NaClO + H2O + CO2 = NaHCO3 + HClO.
Окиснювальна здатність кислот HXO і іонів 
 в том ж ряду термодинамічної точки зору зменшується. Це слідує із порівняння величин стандартних потенціалів Ео (табл.9).
в том ж ряду термодинамічної точки зору зменшується. Це слідує із порівняння величин стандартних потенціалів Ео (табл.9).
Високу окиснювальну здатність гіпохлоритів илюструють наступні реакції:
NaСlO +2NaI + H2O = NaCl + I2 + 2NaOH
2NaClO + MnCl2 + 4NaOH = Na2MnO4 + 4NaCl + 2H2O.
Швидкість же реакції окиснення і диспропорціонування в ряду HClO-HBr-HIO  зростає. Це зумовлено зростанням радіуса галогену і його доступності до атаки реагенту.
зростає. Це зумовлено зростанням радіуса галогену і його доступності до атаки реагенту.
Таким чином, термодинамічна і кінетична стабільність в ряду HClO-HBrO-HIO змінюються в протилежних напрямках. Дійсно, константа рівноваги диспропорціонування гіпохлорит-іона велика (табл.9), але швидкість розпаду мала. Тому гіпохлорити можна отримати дією хлора на холодный розчин лугу. В промисловості таким чином одержують білильне вапно (формула CaOCl2 відображає основний склад, в продуктах взаємодії присутні Ca(OCl)2, Ca(OH)2, CaCl2 які містять кристалізаційну воду.):
Ca(OH)2 + Cl2 = CaCl(OСl) +H2O
Для іонів 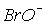 та
та 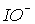 константи рівноваги диспропорціонування менше, за
константи рівноваги диспропорціонування менше, за  . Однак швидкості їх розпаду набагато більші. Наприклад, натрій гіпоброміт диспропорціонує при t > 0oC за реакцією:
. Однак швидкості їх розпаду набагато більші. Наприклад, натрій гіпоброміт диспропорціонує при t > 0oC за реакцією:
3NaBrO. xH2O  NaBrO3 + 2NaBr + 3xH2O.
NaBrO3 + 2NaBr + 3xH2O.
Оксокислоти HXO2
Із оксокислот HXO2 відомі лише хлориста кислота HClO2. Вона не утворюється при диспропорціонуванні HClO. Водні розчини HClO2 отримують обробкою Вa(ClO2)2 сульфантою кислотою с наступним відфільтровуванням осаду BaSO4:
Ba(ClO2)2 + H2SO4 = BaSO4  + 2HClO2.
+ 2HClO2.
HClO2 - кислота середньої сили: рКа = 2.0 (табл.8). Хлорити використовують для відбілювання. Їх одержують м’яким відновленням ClO2 в лужному середовищі:
2СlO2 + Ba(OH)2 + H2O2 = Ba(ClO2)2 + 2H2O + O2
2СlO2 + PbO + 2NaOH = PbO2 + 2NaClO2 + H2O.
Броміт барію вдалося синтезувати за реакцією:
Ba(BrO)2 + 2Br2 + 4KOH 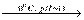 Ba(BrO2)2 +4KBr + 2Н2О.
Ba(BrO2)2 +4KBr + 2Н2О.
Властивості кислот HXO3 та їх солей.
Оксокислоти HXO3 більш стійкі, ніж HX. Хлорновата HClO3 і бромновата HBrO3 кислоти отримані в розчинах з концентрацією нижче 30%, а тверда йодновата HIO3 виділена як індивідуальна речовина.
Розчини HClO3 і HBrO3 одержують дією розбавленої H2SO4 на розчини відповідних солей, наприклад,
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4  .
.
При концентрації розчинів вище 30% кислоти HBrO3 і HClO3 розкладаються з вибухом.
Тверду йодновату кислоту можна одержати окисненням йода концентрованою HNO3, хлорноватою кислотою чи гідроген пероксидом: I2 + 5Н2О2 = 2HIO3 + 4H2O.
При нагріванні відбувається її дегідратація:
2 HIO3  I2O5 + H2O.
I2O5 + H2O.
Вдастивості кислот HXO3, а також міжатомні відстані (l) і валентні кути в пірамідальних іонах ХО3-представлені в табл.10.
Таблиця 10. Будова і властивості іонів ХО3-
| Свойства | ClO3- | BrO3- | IO3- |
| l X-O,Å | 1.48 | 1.65 | 1.81 |
| Ð OXO | 1070 | 1040 | 1000 |
| Eo, B (pН = 0) :6H++ХО3-+5е=1/2X2 +3H2O | 1.47 | 1.52 | 1.20 |
| pН=14: ХО3-+3H2O+6e=X-+6OH- | 0.62 | 0.61 | 0.26 |
| pКа HХO3 = H++ ХО3- | -1.2 | 0.7 | 0.8 |
| Константи рівноваги 4XO3- = X- + 3XO4- | 1029 | 10-33 | 10-53 |
Водні розчини HXO3 є сильними кислотами. В ряду HClO3-HBrO3-HIO3 спостерігається деяке зменшення сили кислот (табл.10). Це можна пояснити тим, що з ростом розміру атома галогену міцність кратного зв’язку Х= О зменшується, що приводить до зменшення полярності зв’язку H-O і зменшенню легкості відриву від неї гідрогену молекулами води.
В кислому середовищі (рН  0) з точки зору термодинаміки окиснювальна здатність зменшується ряду BrO3-ClO>3- > IO3-, що витікає із співставлення величин стандартних потенціалів Ео (табл.10). Дійсно, в кислому середовищі при взаємодії натрій бромату з хлором чи йодом виділяється вільний бром:
0) з точки зору термодинаміки окиснювальна здатність зменшується ряду BrO3-ClO>3- > IO3-, що витікає із співставлення величин стандартних потенціалів Ео (табл.10). Дійсно, в кислому середовищі при взаємодії натрій бромату з хлором чи йодом виділяється вільний бром:
2NaBrO3 + Cl2 = 2NaClO3 + Br2
2NaBrO3 + I2 = 2NaIO3 + Br2,
а взаємодія йоду с розчином натрій хлорату приводить до виділення хлору:
2NaСlO3 + I2 = 2NaIO3 + Cl2
Термодинамічна стабільність іонів ХО3- по відношенню до розпаду на пергалогенат ХО4- і галогенід Х- іони зростає від ClO3- до ІО3- (табл.10). Відомо також, що HClO3 існує лише в розчинах, а HIO3 виділена у вигляді безбарвних кристалів (т.пл.110оС). Відзначимо таку важливу обставину. Як зазначалось, с точки зору термодинаміки в ряду 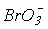
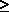
 >
> 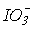 окиснювальна здатність зменшується, а стабільність до диспропорціонування зростає. Реальний же склад продуктів визначається кінетикою, тобто механізмом відповідних реакцій. Виходить так, що швидкість реакцій окиснення і диспропорціонування в тому ж ряду збільшується:
окиснювальна здатність зменшується, а стабільність до диспропорціонування зростає. Реальний же склад продуктів визначається кінетикою, тобто механізмом відповідних реакцій. Виходить так, що швидкість реакцій окиснення і диспропорціонування в тому ж ряду збільшується:  <
< 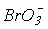 <<
<< 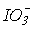 . Таким чином, термодинаміка і кінетика в даному випадку працюють в протилежних напрямках.
. Таким чином, термодинаміка і кінетика в даному випадку працюють в протилежних напрямках.
Це зумовлено зростанням розміру атома галогену r(Cl)<r(br)E(Br-O)>E(I-O) і ступеню екранування атомами оксисену відповідного атома галогену. Всі ці фактори і приводять до зростання швидкостей реакцій, що розглядаються. Дійсно, у водних розчинах реакція 4KClO3 = 3KClO4 + KCl не відбувається навіть при кип’ятінні. По кінетичним причинам іон ClO3- не відновлюється, а йон ІО3-, навпаки, легко відновлюється йодид-іоном.
Наприкінці відзначимо, що солі більш стійкі до нагрівання, ніж відповідні кислоти. Так деякі із йодатів зустрічаються в природі у вигляді мінералів, наприклад, лаутарит NaIO3. При нагріванні твердого КСIO3 до 500оС можливо диспропорціонування
4KClO3  3KClO4 +KCl,
3KClO4 +KCl,
(за наявності каталізаторів, наприклад, MnO2, вдається не тільки знизити температуру розкладу, а й змінити шлях процесу: 2KClO3  2 KCl +3О2
2 KCl +3О2
а при більш високої температурі розклад розлаву KClO4 : KClO4 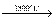 KCl +2O2 .
KCl +2O2 .
Склад продуктів розкладу броматів і йодатів залежить від природи катіона, наприклад,
2KIO3  2KI + 3O2 (аналогічно и бромати лужних металів);
2KI + 3O2 (аналогічно и бромати лужних металів);
2Cu(BrO3)2  2CuO + 2Br2 + 5O2 (аналогічно йодат кальцію);
2CuO + 2Br2 + 5O2 (аналогічно йодат кальцію);
5Ba(IO3)2  Ba5(IO6)2 +4I2 +9O2
Ba5(IO6)2 +4I2 +9O2
3.4. Оксокислоти HXO4
В табл.11 приведены данные о свойствах кислот HXO4, а также о межатомных
расстояниях и валентных углах в тетраэдрических ионах  .
.
Таблиця 11. Властивості кислот HXO4
| Властивості | 
| 
| 
|
| l X-O, Å | 1.43 | 1.61 | 1.78 |
| OXOÐo | ~1000 | 1090 | 1070 |
| pKа: HXO4=H+ + XO4- | -10 | ~ -9 | - |
| H5IO6=H+ + H4IO6- | 3.0 | ||
| H4IO6-= H+ + H3IO62- | 8.0 | ||
| Eo, B; pН =0: XO4- +8H+ + 7e =1/2X2 + 4H2O | 1.39 | 1.59 |
Хоча метаиодна кислота HIO4 і деякі її солі невідомі, йод(VII) через збільшення радіусу в ряду Сl-Br-I и підвищення його координаційного числа утворює, головним чином, гідроксопохідні складу H5IO6, в яких атом йода октаедрично оточений атомами оксигену і п’ятьома гідроксильними групами.
Хлорна кислота (Тпл.= -102оС, Ткип.= 90оС) отримана в індивідуальному стані нагріванням твердої солі КClO4 зконцентрованою H2SO4 с наступною відгонкою при зниженому тиску:
КClO4,тв.+ H2SO4,конц  HClO4 + KHSO4
HClO4 + KHSO4
HClO4 легко вибухає при контакті з органічними речовинами.
Бромна кислота HBrO4 відома лише в розчинах (не вище 6М), які отримують підкисненням перброматів NaBrO4, які, в свою чергу, вдалося синтезувати окисненням броматів фтором в розбавлених лужних розчинах (бромати можна окиснити до перброматів за допомогою XeF2 чи електролітично):
NaBrO3 + F2 + 2NaOH = NaBrO4 + 2NaF +H2O.
Хлорная кислота - одна із сильних кислот. За силою до неї наближається бромна кислота.
Иодна кислота існує в декількох формах, головними із яких є ортойодна H5IO6 і метайодна HIO4 кислоти. Ортойодна кислота утворюється у вигляді безбарвних кристалів при обережному упарюванні розчину, утвореного за обмінною реакцією
Ba3(H2IO6)2 + 3H2SO4 = 3BaSO4  + 2H5IO6.
+ 2H5IO6.
(вихідний перйодат синтезують за схемою:
NaIO3 + 4NaOH + Cl2 
| Na3H2IO6 
| + 2 NaCl + H2O |
| (pH=7-8) | ||
| 2Na3H2IO6 + 3Ba(NO3)2 = | Ba3(H2IO6)2 
| + 6NaNO3. |
В кристалічному стані речовина має молекулярну структуру: у вузлах кристалічної решітки знаходяться октаедри (HO)5IO. Ортойодна кислота у водних розчинах проявляє властивості слабкої п’ятиосновної кислоти. Константи дисоціації H5IO6 за 4-ою і 5-ою ступенями настільки малі, що у водних лужних розчинах можливо відтитрувати тільки перші три протона, що відповідає утворенню солей типу KH4IO6, K2H3IO6 и K3H2IO6 (Сіль складу K4HIO6 отримати не вдається).
У ряді випадків із розчинів виділяється середня сіль, наприклад, Ag5IO6, стікість якої обумовлена високою енергією кристалічної решітки і полімерною структурою.
При обережному нагріванні ортойодної кислоти утворюється метайодна кислота
H5IO6  HIO4 + 2H2O.
HIO4 + 2H2O.
Як і у випадку кислот HXO3, термодинамічна і кінетична стабільність кислот HXO4 і їх солей різніться. Термодинамічна стійкість йодної кислоти и перйодатів до розкладу вище, ніж хлорної кислоти і перхлоратів. Безбарвна концентрована HClO4 навіть при кімнатній температурі синтезу темніє через утворення оксидів хлору з больш низькими ступенями окиснення.
Метайодна кислота розкладається тільки при нагріванні 2HIO4  2HIO3 + O2 .
2HIO3 + O2 .
В ряду ClO4-BrO-4-IO-4- (H5IO6) спостерігається аномалія у зміні термодинамічної стабільності і окисної здатності: бромна кислота та її солі менш стабільні, однак більш сильні окисники, ніж відповідні кислоти і солі хлору Cl (VII)ійода I (VII) (табл.11,). Аналогіні порушення в послідовності змін властивостей оксокислот спостерігаються і для інших елементів 4-го періоду – SeO42-, AsO43-, GeO44-. Такі аномалії іноді називають вторинною періодичністю, розуміючи, наприклад, що властивості сполук брому схожі на властивості аналогічних сполук фтору. Ці аномалії у властивостей перброматів пов’язані з зниженням міцності зв’язку Br-O порівняно із зв’язком Cl-O. В свою чергу, це викликано зрстанням енергій 4s- і 4p- орбіталей атома брому порівняно з енергіями 2s- і 2p- орбіталей оксигену, а, таким чином, із зменшенням взаємодії (перекриття) 4s-, 4p- орбяталей брому і 2s, 2p -орбіталей оксигена (енергії 2s-, 2p-, 3s-, 3p-, 4s- і 4p- атомних орбіталей складають 32.4, 15.9, 25.3, 13.7, 24.1 и 12.5 еВ відповідно). Підвищення стабільності і зменшення окислювальної здатності оксосполук при переході Br (VII)  I (VII) зумовлено особливостями будови і збільшення міцності зв’язку I-O в октаедричних йонах IO6 порівняно із зв’язком Br-O в тетраедрах BrO4-. Атом йода порівняно з атомом брому має більший радіус, для нього характерно координаційне число 6. Зростання числа координованих атомів оксигену приводить до росту числа електронів на зв’язуючих молекулярных орбіталях і, відповідно, до підвищення міцності зв’язку.
I (VII) зумовлено особливостями будови і збільшення міцності зв’язку I-O в октаедричних йонах IO6 порівняно із зв’язком Br-O в тетраедрах BrO4-. Атом йода порівняно з атомом брому має більший радіус, для нього характерно координаційне число 6. Зростання числа координованих атомів оксигену приводить до росту числа електронів на зв’язуючих молекулярных орбіталях і, відповідно, до підвищення міцності зв’язку.
Стійкість солей вище, ніж відповідних оксокислот HXO4. Кристали солей, наприклад, KClO4, побудовані із йонів K+ і ClО4-, електростатична взаємодія яких збільшує енергію кристалічної решітки и підвищує стабільність.
Розглянуті термодинамічні закономірності не співпадають с кінетичними: швидкість реакції окиснення за участю йонов BrO4- і особливо ClО4- повільна. Наприклад, взаємодія 70%-ої HClO4 з магнієм супроводжується виділенням водню:
Mg + 2 HClO4 = Mg(ClO4)2 + H2,
а 1М розчин HBrO4 не окиснює хлор із HCl. У випадку ж H5IO6 подібна реакція перебігає без кінетичних ускладнень:
H5IO6 + 2HCl = HIO3 + Cl2 + 3H2O.
Увеличение скорости реакции окисления в ряду ClO4-BrO-4-IO-4- (H5IO6), зумовлено ростом радіуса атома галогену, зростанням доступності його до атаки атомами відновника, а у випадку H5IO6 існуванням коротких (1.78Å) і довгих (1.89Å) зв’язків I-O.
На схемі 12 представлені тенденції у зміні кислотних властивостей, термодинамічної стабільності і окиснювальної здатності (рН = 0) оксокислот галогенів.
| HClO | 
| HClO2 | 
| HClO3 | 
| HClO4 |
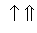
| 
| 
| ||||
| [HBrO] | 
| HBrO3 | 
| HBrO4 | ||
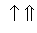
| 
| 
| ||||
| [HIO] | 
| HIO3 | 
| HIO4 | ||
| (H5IO6) |
Схема.12. Зростання сили кислот ( ), термодинамічної стабільності (
), термодинамічної стабільності ( ) і окиснювальної здатності (
) і окиснювальної здатності ( ) оксокислот галогенів.
) оксокислот галогенів.






