Опыт 1. Проведение качественных реакции на катионы и анионы биогенных элементов. Реакция ионa Pb2+ с йодидами.
Приборы и реактивы: штатив с пробирками, раствор соли Pb2+, раствор йодида калия КI, Н2О (дистиллированная), сухое горючее, держатель для пробирок при нагревании.
Цель работы: Проведение качественных реакции на катионы и анионы биогенных элементов.
В пробирку помещают 3 капли раствора соли Pb2+, добавляют 1-2 капли раствора йодида калия КI и наблюдают выпадение осадка PbI2, отметить его цвет. К полученному осадку добавляют 2 мл воды и нагреть до растворения осадка. ВНИМАНИЕ: нагревать осторожно: отверстием в сторону от себя и от соседа, т.к. возможен выброс осадка из пробирки! После нагревания и растворения осадка раствор охлаждают и наблюдают повторное выпадение осадка в виде искрящихся кристаллов (золотые кристаллы).
Опыт 2. Проведение качественных реакции на катионы и анионы биогенных элементов. Реакция ионa Ag+с хлоридами.
Приборы и реактивы: штатив с пробирками, раствор AgNO3 , растворы 2 н. НС1, HNO3 и концентрированный раствор NH3, Н2О (дистиллированная), сухое горючее, держатель для пробирок при нагревании.
В четыре пробирки помещают по 1-2 капли раствора AgNO3 и столько же 2 н. НС1. Определяют растворимость полученного осадка AgCl в НС1, HNO3 и концентрированном растворе NH3.
Опыт 3. Проведение качественных реакции на катионы и анионы биогенных элементов. Реакция восстановления ионa Ag+.
В чистую пробирку вносят 5-6 капель аммиачного раствора серебра и прибавляют 1-2 капли 10% раствора формальдегида или уксусного альдегида. Пробирку слегка подогревают. Выделяется металлическое серебро в виде блестящего зеркального налета на стенках пробирки или образуется черный осадок металлического серебра.
Химизм реакции:
2 Ag(NH3)2OH + 3H2O ® Ag2O¯ + 4 NH4OH
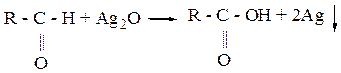
Сделать вывод.
Опыт 4. Реакция катиона Zn2+ с нитратом кобальта.
Приборы и реактивы: штатив с пробирками, растворы ZnSO4 и Co(NO3)2,, спички, чашка Петри, держатель для пробирок при нагревании, фильтровальная бумага.
Полоску фильтровальной бумаги смачивают растворами соли цинка ZnSO4 и нитрата кобальта Co(NO3)2, подсушивают и сжигают. Фиксируют цвет золы (зеленый цвет – «зелень Ринмана»), вызванный образованием CoZnO2.
Опыт 5. Реакция Fе2+ с гексацианоферратом (III) калия.
Приборы и реактивы: штатив с пробирками, раствор соли железа (II), 2 н. НС1, раствор K3[Fe(CN)6], сухое горючее.
В две пробирки помещают по 2-3 капли раствора соли железа (II), 1-2 капли 2 н. НС1 и 1- 2 капли раствора K3[Fe(CN)6]. Наблюдают образование и цвет осадка турнбулевой сини Fe3[Fe(CN)6]2.
Опыт 5. Реакция Fе3+ с тиоцианатами (роданидами).
В пробирку помещают 3-4 капли раствора соли железа (III), прибавляют 1-2 капли роданида аммония NH4SCN – реактива на катион Fe3+. Наблюдают появление кроваво-красной окраски комплекса [Fе(SCN)3].
Опыт 6. Получение анионного комплексного соединения Zn3[Fe(CN)6]2
В пробирку внести 3-4 капли раствора соли цинка (II) Zn2+ и добавить 5 капель раствора соли К3[Fe(CN)6]. Наблюдать образование желто-коричневого осадка. Записать уравнения реакции в молекулярной и ионной форме. В соединении Zn3[Fe(CN)6]2 определить заряд комплексообразователя, лигандов, координационное число, назвать К.С. Записать выражение константы нестойкости для комплексного иона.
Опыт 7. Получение катионного комплексного соединения [Сu(NH3)4]SO4
В пробирку внести 4 капли раствора соли меди (II) Сu2+ и добавить по каплям концентрированный раствор NН4ОН до появления голубого осадка. К полученному осадку продолжать по каплям приливать NН4ОН до полного растворения осадка. Записать уравнения протекающих реакций.
В ходе реакции образуется комплексное соединение [Сu(NH3)4]SO4. Определить комплексообразователь и его заряд, координационное число, заряд комплексного иона. Назвать соединение. Составить уравнение диссоциации комплексного иона и выражение константы нестойкости. К какому типу К.С. относится данное соединение.






