Сродство к электрону — количество энергии, выделяющееся при присоединении электрона к атому, молекуле пли радикалу. Сродство к электрону выражается обычно в электрон-вольтах. Значение величины Сродства к электрону важно для понимания природы химической связи и процессов образования отрицательных ионов. Чем больше Сродство к электрону, тем легче атом присоединяет электрон. Сродство атомов металлов к электрону равно нулю, у атомов неметаллов Сродство к электрону тем больше, чем ближе стоит элемент (неметалл) к инертному газу в периодической системе Д. И. Менделеева. Поэтому в пределах периода усиливаются неметаллические свойства по мере приближения к концу периода.
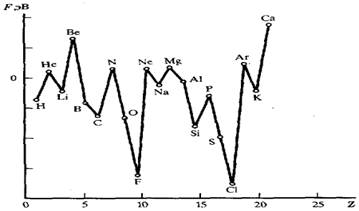
Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов.Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s² (Be, Mg, Zn) и s²p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As)[11]:
Li Be B C N O F Ne
Электронная конфигурация s1 s² s²p1 s²p² s²p³ s²p4 s²p5 s²p6
ε, эВ -0,59 0,19 -0,30 -1,27 0,21 -1,47 -3,45 0,22 Энергия сродства к электрону - это энергия, которая выделяется при присоединении электрона к нейтральному атому Эо + ē → Э- + Еср.
Чем больше Еср, тем легче атом присоединяет электроны и тем сильнее проявляются его окислительные и неметаллические свойства элементов.
Выражается обычно в кДж/моль.
В периодах слева направо с возрастанием заряда ядра и уменьшением радиуса атома Еср увеличивается, в группе сверху вниз с увеличением радиуса атома Еср уменьшается.
Так Еср большинства металлов невелика или даже отрицательна, поэтому они не образуют устойчивых анионов.
Проявления периодического закона в отношении электроотрицательности Атомы присоединяют или отдают электроны в процессе химического взаимодействия. Комплексной характеристикой атома, учитывающей его способность и к присоединению, и к отдаче электронов, является электроотрицательность - ЭО (χ).
ЭО элемента - условная величина, характеризующая способность его атомов в химических соединениях притягивать к себе электроны от атомов-партнеров (тех, с которыми непосредственно связан данный атом).
Величина ЭО зависит от Еи и Еср и упрощено может быть определена
χ = 1/2 (Еи + Еср)
Для практической оценки этой способности атомов используют условную шкалу, относительных электроотрицательностей. Согласно ей самый ЭО элемент F, а наименее ЭО - Fr.
Очевидно, что в периоде слева направо с уменьшением радиуса атома и увеличением Еи и Еср увеличивается ОЭО происходит ослабление восстановительных и усиление окислительных свойств, а в группе сверху вниз с увеличением радиус атома и уменьшением Еи и Еср ОЭО уменьшается, происходит ослабление окислительных и усиление восстановительных свойств атомов химических элементов.
По величине ОЭО можно отнести элемент к металлам или неметаллам.
Как правило, неметаллы имеют значения ОЭО больше 2 (по другим источникам больше 1,7). Они располагаются в А-группах правой верней части ПС над условной диагональю В - Аt. У металлов значение ОЭО < 2 (<1,7). Наиболее активные металлы находятся в нижнем левом углу ПС в А-группах. Несколько элементов (В, Si, Ge, As, Te) со значение ОЭО близким к 2, проявляют промежуточные свойства, их иногда называют полуметаллы.
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселенности, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остается необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону[12].
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах — её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая — у p-элементов VII группы. Неметаллические и окислительные свойства элементов по периоду слева направо усиливаются, а по группе сверху вниз уменьшаются.







