Кафедра ХХТ
Лаборатория №_______
Отчет по лабораторной работе № 3
Электролитическая диссоциация. Гидролиз.
Условия выпадения и растворения осадков.
ФТФ
Группа: ФФ-41
Студентка: Султанова Валентина Болатовна
Преподаватель: Турло Евгений Михайлович
Дата выполнения работы: _______________
г. Новосибирск, 2014
Цель работы: Ознакомление с процессами, протекающими в водных растворах электролитов – диссоциация и гидролиз, сравнение свойств растворов сильных и слабых электролитов, гомогенных и гетерогенных равновесий в растворах электролитов.
К сильным электролитам относятся такие, которые в 0,1 М растворе имеют α > 30%. Сильными электролитами являются:
-почти все растворимые соли
-многие минеральные кислоты
-основания щелочных и щелочно - земельных металлов
У средних электролитов α = 3…30% в 0,1 М растворах;
Для слабых электролитов в 0,1 М растворах α < 3 %;
Процесс обменного взаимодействия ионов соли с водой, который приводит к изменению среды раствора, называется гидролизом соли.
Различают гидролиз соли:
1) По катиону (соли, образованные слабыми основаниями и сильными кислотами), который приводит к связыванию гидроксид-ионов воды и накоплению ионов водорода, среда кислая, рН < 7
2) По аниону (соли, образованные сильными основаниями и слабыми кислотами), который приводит к связыванию ионов водорода от воды и накоплению ионов ОН, среда щелочная, рН > 7
3) По катиону и аниону (соли, образованные слабыми основаниями и слабыми кислотами), рН близок к нейтральной среде
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Для процесса гидролиза характерны следующие закономерности.
1. Гидролиз соли усиливается с повышением температуры и разбавлением раствора.
2. Реакции гидролиза соли обратима. В соответствии с принципом Ле Шателье процесс гидролиза должен подавляться при подкислении или подщелачивании
3. Гидролиз, в результате которого образуются малорастворимые или газообразные продукты, удаляющиеся из сферы реакции, необратим.
Экспериментальная часть.
Опыт № 1. Сравнение химической активности сильных и слабых электролитов
а)
| Вещество | Цвет на индикаторной бумажке | рН | |
| HCl | |||
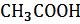
|
б)
| Вещество | Цвет на индикаторной бумажке | рН | |
| NaOH | |||
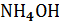
|
Вывод:
Опыт № 2. Влияние одноименного иона на степень диссоциации слабого электролита (смещение равновесия диссоциации)
| Номер пробирки | Окрас раствора | Причины изменения | |
| 1. | |||
2. 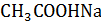
|
Вывод:
Опыт № 3. Определение характера среды в растворах солей. Гидролиз солей
| Номер пробирки | Вещество | рН | Реакция среды |
Вывод:
Опыт 4. Влияние температуры на степень гидролиза (смещение равновесия гидролиза)
Вывод:






