1. В пробирке даны три кислоты: уксусная, оксиуксусная, бензойная. В каждую пробирку добавлен фенолфталеин, а затем щелочь. Сначала появившееся окрашивание постепенно исчезает.
Объяснить наблюдаемое явление. Ответ обосновать и написать уравнение реакции.
2. К раствору щелочи добавили фенолфталеин и гликолевой кислоты. Малиновый цвет фенолфталеина исчез.
Объяснить наблюдаемое явление. Ответ обосновать. Написать уравнения химической реакции.
3. В структуре молочной кислоты содержаться две функциональные группы которые придают соединению кислотные свойства. Однако, установлено, что на реакцию с молочной кислотой расходуется лишь 1 моль щелочи.
Объяснить причину данного явления. Написать уравнение хим. реакции.
4. Неизвестное вещество нагревали в пробирке с концентрированной серной кислотой. В результате реакции наблюдали выделение пузырьков газа. Затем в пробирку была добавлена фуксин-сернистая кислота, появилось малиновое окрашивание.
Объяснить наблюдаемое явление. Написать уравнение.
ТЕМА: «ГИДРОКСИКИСЛОТЫ. ХИМИЧЕСКИЕ СВОЙСТВА»
Актуальность темы:
Данная тема очень важна для студентов фармацевтического отделения, так как отдельные гидроксикислоты: гликолевая, молочная – являются продуктами обмена веществ, нарушение которого позволяет определить эти кислоты в биологических веществах организма человека. Молочная кислота используется как наполнитель при приготовлении порошков и таблеток, ее соли находят применение в медицине. Лимонная кислота в виде соли применяется для консервирования и временного хранения крови. Этот материал необходим при изучении специальных дисциплин, а также в будущей профессиональной деятельности фармацевта.
Цель занятия:
1. Изучить теоретический материал по теме;
2. Закрепить написанием соответствующих уравнений реакций;
План занятия:
1.Определение гидроксикислот.
2.Отдельные представители (винная, молочная, лимонная кислоты).
3.Получение гидроксикислот
4.Химические свойства кислот
а) свойства, связанные с гидроксильной группой;
б) свойства, связанные с карбоксильной группой;
в) специфические реакции на α -, β -, γ - гидроксикислоты
Рекомендуемая литература
1. «Органическая химия» С.Э. Зурабян, А.П. Музин, М.2011, с. 238
2. «Органическая химия» под ред. Н.А. Тюкавкиной, М. «Медицина», 1989г. с. 265-283
ТЕМА: «ФЕНОЛОКИСЛОТЫ»
Актуальность темы: Данная тема очень важна для студентов фармацевтического отделения, так как представители фенолокислот: салициловая кислота, ацетилсалициловая кислота, салол, метилсалицилат являются лекарственными препаратами, широко использующими в медицине в качестве антисептических, раздражающих, противовоспалительных, жаропонижающих средств. Этот материал необходим студентам для успешного изучения специальных дисциплин, а также в будущей профессиональной деятельности фармацевта.
Цели занятия:
Обучения: - изучить теоретический материал по теме: «Фенолокислоты»
- закрепить знания по свойствам гетерофункциональных соединений.
Воспитания: - аккуратность, внимание, коллективизм.
Развития: - логического мышления, познавательного интереса.
План занятия:
1. Определение фенолокислот
2. Номенклатура
3. Получение фенолокислот
4. Химические свойства
а) реакции на карбоксильную группу
б) реакции на фенольную группу
5.Отдельные представители: салициловая кислота, ацетилсалициловая кислота (аспирин), салол.
Рекомендуемая литература.
1. А.И. Артеменко «Органическая химия», М.: «Высшая школа», 2004г.
2. «Органическая химия» С.Э. Зурабян, А.П. Лузин, М., 2011г.
3. «Органическая химия» под ред. Н.А. Тюкавкиной, М.: «Медицина», 1989г.
Вопросы для самоподготовки:
1. Напишите схему получения салициловой кислоты из бензола.
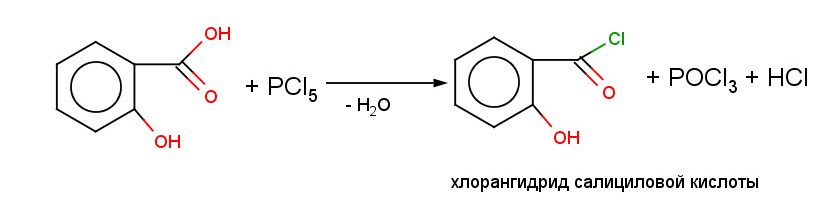
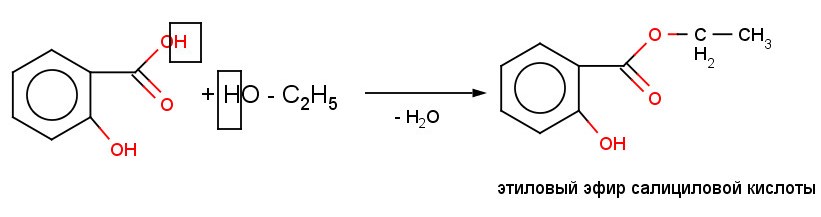
2. Напишите всевозможные реакции взаимодействия салициловой кислоты со щелочью: метиловым спиртом, РСl5, аммиаком, уксусной кислотой.
3. Напишите уравнение фармакопейной реакции ацетилсалициловой
кислоты.
4. Как практически распознать бензойную кислоту, салициловую кислоту,
салол, аспирин.
Перечень знаний, навыков и умений, которыми студенты должны овладеть в результате изучения данной темы:
Знать: - номенклатуру фенолокислот
- способы получения
- физические свойства фармакопейных препаратов
- химические свойства
а) на карбоксильную группу
б) на фенольную группу
- фармакопейные реакции
Уметь: - выполнять фармакопейные реакции на салициловую кислоту, ацетилсалициловую кислоту (аспирин), салол.
- решать ситуационные задачи.
ТЕМА: «ФЕНОЛОКИСЛОТЫ»
(теоретический материал)
Фенолокислоты - это производные ароматических углеводородов, в молекуле которых одна или несколько атомов водорода в ядре замещены на гидроксильную группу и атомы водорода в ядре или боковой цепи на карбоксильную группу.
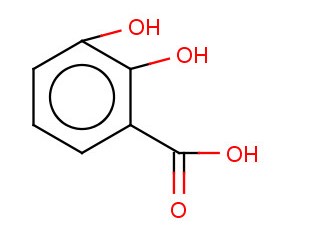
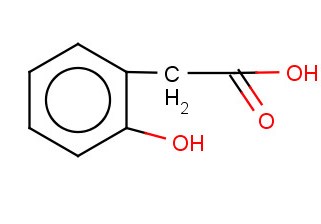
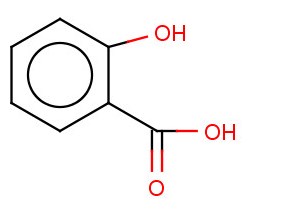
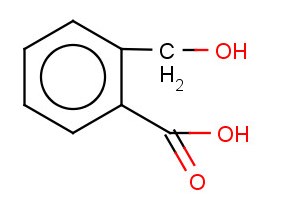
это спиртокислота, т.к ОН- группа находится в боковой цепи.
Называют Фенолокислоты по рациональной номенклатуре и ИЮПАК так же, как и ароматические углеводороды.
Рациональная номенклатура 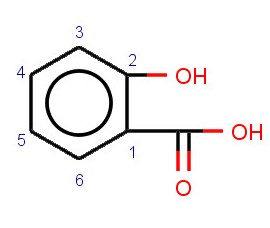
ортогидроксикарбоксибензол, ортогидроксибензойная кислота,
ортокарбоксифенол
ИЮПАК
1 — карбокси 2 — гидроксибензол
2 - гидроксибензолкарбоновая кислота
В природных условиях фенолокислоты содержатся в растениях в свободном состоянии или в виде сложных эфиров. Синтетическим путем фенолокислоты получают 2 способами.
1. Из фенолятов.
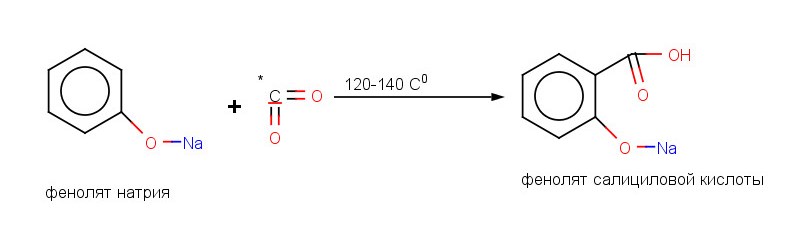
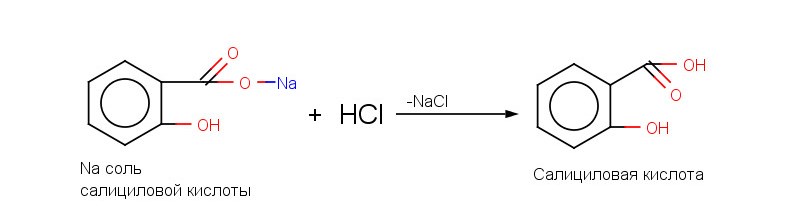
2. Из ароматических кислот.
T0
H2SO4(k) SO3H+ + OH-
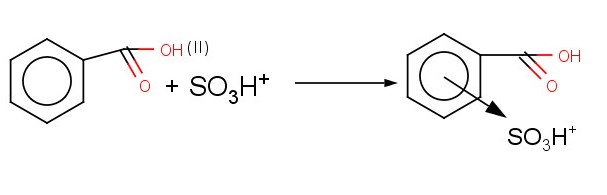
π-комплекс
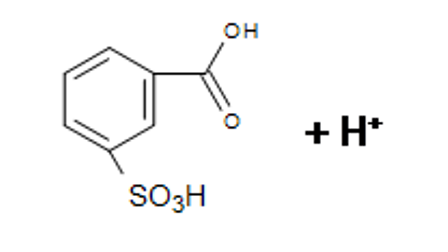
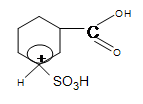
δ-комплекс H+ + OH- = H2O
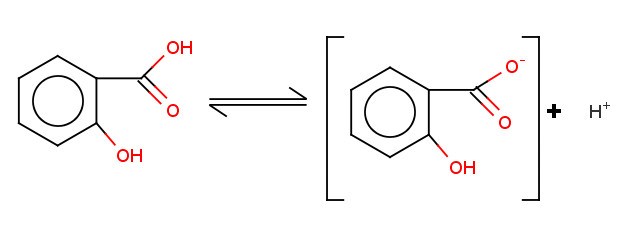
Фенолокислоты являются соединениями со смешанными функциями, т.к. они проявляют свойства ароматических кислот и фенолов.
Салициловая кислота имеет два центра кислотности - карбоксильную группу и фенольную, причем кислотные свойства выражены сильнее, чем ее мета- и пара изомеры.
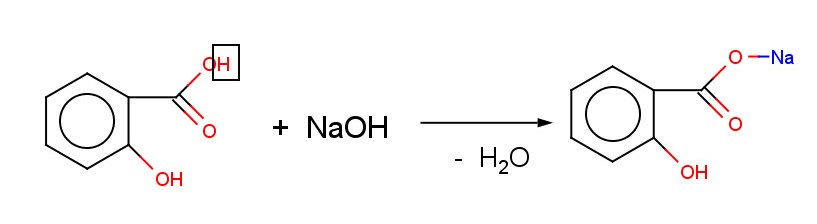
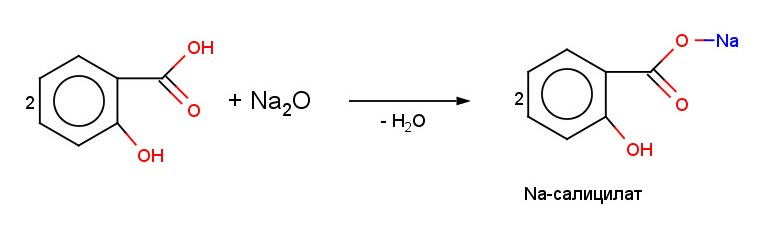
Na-салицилат
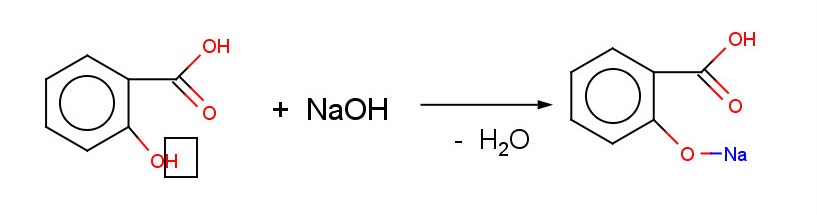
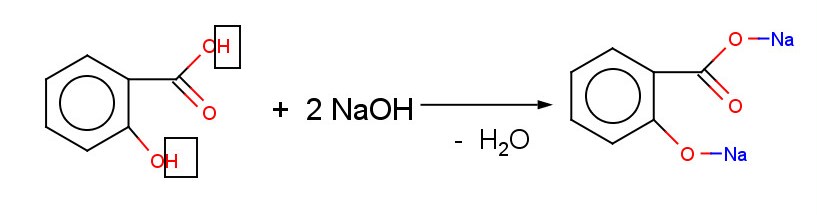 Фенолят салициловой кислоты
Фенолят салициловой кислоты
Фенолятосоль
Реакции на фенольную группу
Тип простой эфир 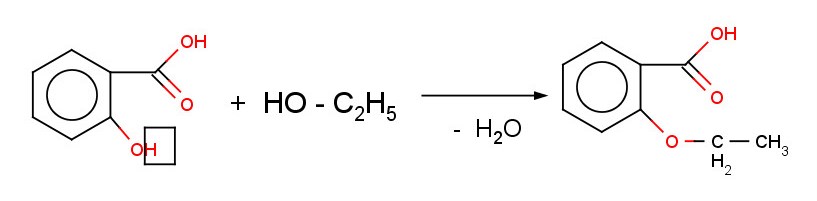
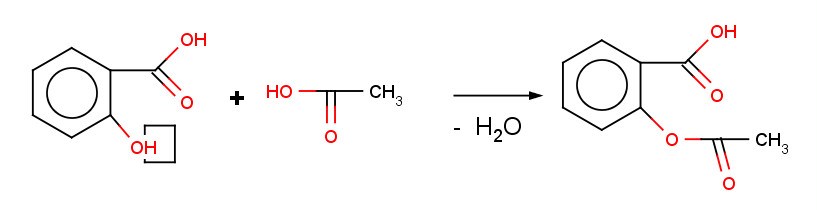
Ацетилсалициловая кислота
(аспирин)
Реакции на карбоксильную группу
Медицинское применение салициловой кислоты и ее производных очень разнообразно. Особенно часто они используются при лечении суставного ревматизма, простудных заболеваний, ангины, как желчегонное и антисептическое, при лихорадочных заболеваниях, как жаропонижающее и дезинфицирующее средство.
Салициловая кислота
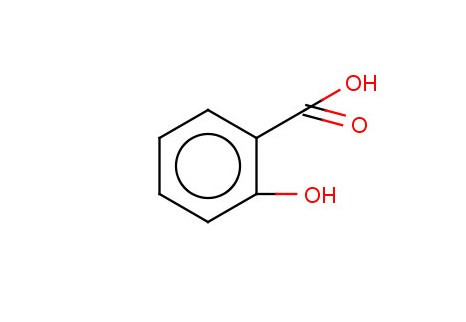
Салициловая кислота в виде своих производных встречается в виде растений.
Салициловая кислота - белые игольчатые кристаллы или легкий кристаллический порошок без запаха, мало растворима в воде, растворима в кипящей воде, легко растворима в спирте, эфире, труднее в хлороформе.
Фармакопейные реакции.
1. С раствором FeCl3 образует фиолетовое окрашивание как водный, так и спиртовой раствор.
2. Декарбоксилирование (отщепление СО2)
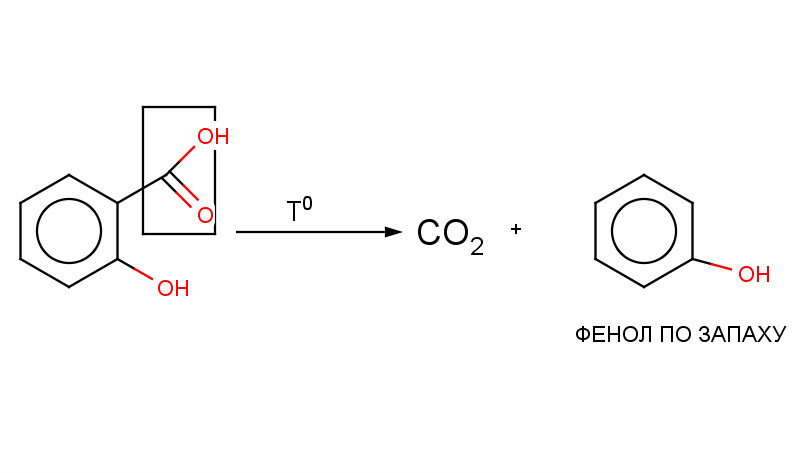
Применяется только наружно (растворы, мази, присыпки, втирания), как бактерицидное, раздражающее и антисептическое средство.
Натрия салицилат
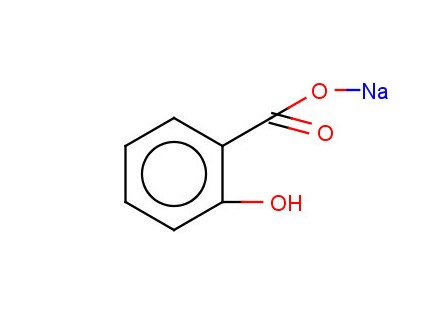
Противовоспалительное, болеутоляющее, жаропонижающее и
противоревматическое средство.
Метилсалицилат
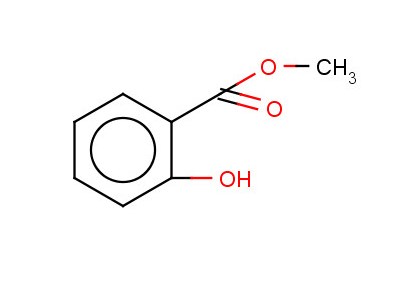
Применяется наружно как противовоспалительное, болеутоляющее и противоревматическое средство.
Ацетилсалициловая кислота (аспирин)
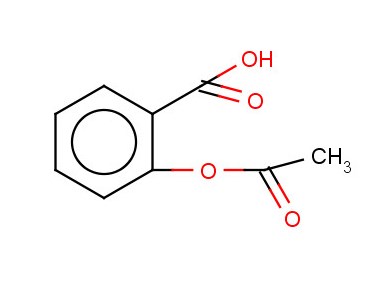
Получение

Физические свойства: бесцветные кристаллы или белый кристаллический порошок со слабокислым вкусом, мало растворим в воде, легко растворим в спирте, хлороформе, эфире. С антипирином, уротропином дает отсыревающие смеси.
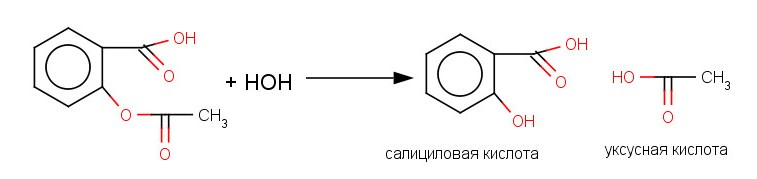 Особенность аспирина - легко гидролизуется даже во влажном воздухе.
Особенность аспирина - легко гидролизуется даже во влажном воздухе.
Доброкачественность аспирина можно определить с раствором FeCl3: доброкачественный аспирин не дает фиолетовое окрашивание, а недоброкачественный образует фиолетовое окрашивание за счет фенольной группы салициловой кислоты.
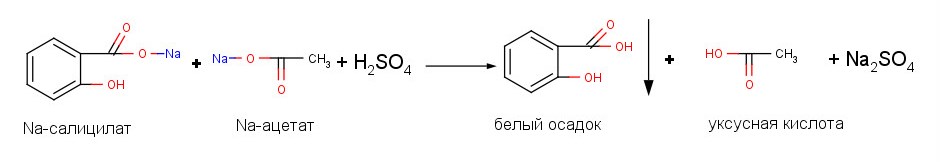
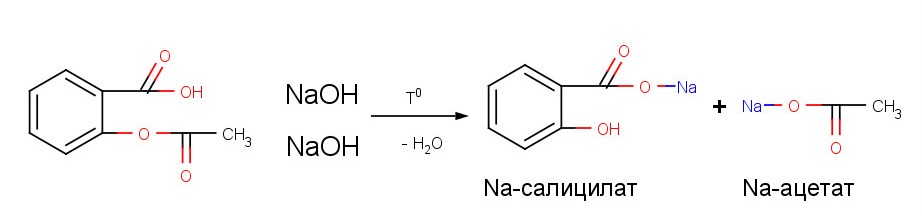 Фармакопейная реакция проходит в два этапа:
Фармакопейная реакция проходит в два этапа:
Применяется как болеутоляющее, противоревматическое и противовоспалительное средство.
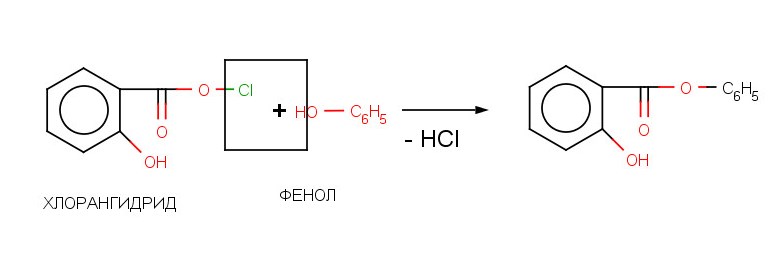
Фенилсалицилат (салол)
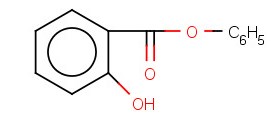
Получение
Физические свойства: белый кристаллический порошок со слабым запахом,
практически нерастворим в воде, растворим в спирте, легко - в хлороформе,
эфире.
Фармакопейная реакция
С раствором FeCI3 образует фиолетовое окрашивание только спиртовой раствор.
Применяется для покрытия кишечно-растворимых таблеток как дезинфицирующее средство.






