Окислительное декарбоксилирование пировиноградной кислоты
Пировиноградная кислота связывает гликолиз с циклом трикарбоновых кислот. Пируват переносится из цитозоля в матрикс митохондрий с помощью переносчика по механизму симпорта с протоном. В матриксе митохондрий пируват превращается в ацетил-КоА. Этот процесс называется окислительное декарбоксилирование пирувата и катализируется пируватдегидрогеназным комплексом (пируватдегидрогеназной системой). Высокая концентрация пируватдегидрогеназного комплекса обнаружена в сердечной мышце и почках.
Пируватдегидрогеназный комплекс является классическим мультиферментным комплексом, в котором промежуточные продукты остаются связанными на поверхности молекулы фермента до образования конечного продукта.
В состав пируватдегидрогеназного комплекса входит 3 фермента и 5 кофакторов. I-й фермент – пируватдегидрогеназа содержит кофактор тиаминпирофосфат (производное витамина В1); II-й фермент – дигидролипоилтрансацетилаза содержит кофакторы липоевую кислоту (ЛК, 6,8-дитиооктановая кислота) и кофермент А (НS-КоА), причем остаток липоевой кислоты присоединен к апоферменту путем образования амидной связи между карбоксильной группой ЛК и ε-аминогруппой лизина белка (образуется длинная «рука», состоящая из 13 атомов углерода); III-й фермент - дигидролипоилдегидрогеназа содержит кофакторы ФАД и НАД+.
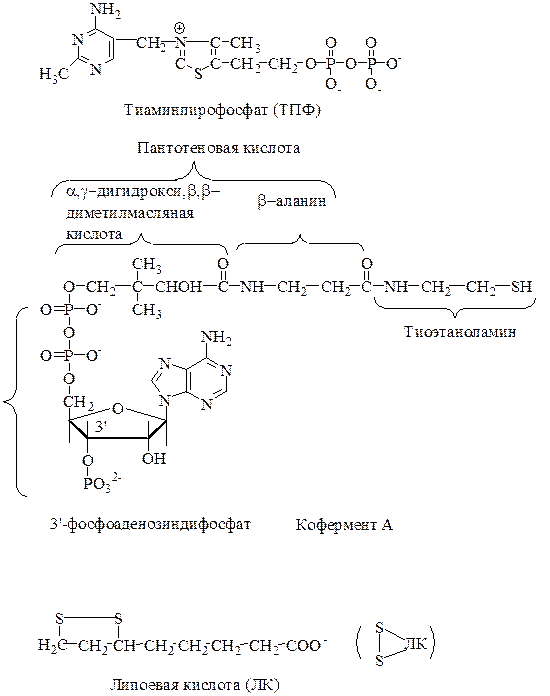
Механизм окислительного декарбоксилирования пирувата
I этап. Пируват взаимодействует с кофактором пируватдегидрогеназы тиаминпирофосфатом. Основную роль играет второй углеродный атом тиазольного кольца ТПФ, который легко теряет протон, превращаясь в карбанион. Карбанион атакует частично положительно заряженный α-углеродный атом пирувата с возникновением связи С−С. Сильно электрофильный атом азота в карбоксиэтил-ТПФ способствует его декарбоксилированию с образованием гидроксиэтил-ТПФ.


II этап. В следующей реакции, катализируемой дигидролипоилтрансацетилазой, гидроксиэтил-ТПФ взаимодействует с липоевой кислотой. Происходит перенос гидроксиэтильной группы на один из атомов серы ЛК. При этом гидроксиэтильная группа окисляется в ацетильную. В процессе окисления гидроксиэтильной группы и восстановления SH-группы ЛК возникает макроэргическая связь. Затем ацетильный остаток переносится на второй кофермент дигидролипоилтрансацетилазы – HS-KoA, а ЛК полностью восстанавливается. Образованный ацетил-КоА отделяется от полиферментного комплекса.
III этап. Восстановленная форма ЛК окисляется дигидролипоилдегидрогеназой.
3. Регуляция пируватдегидрогеназного комплекса. Превращение пирувата в ацетил-КоА – процесс необратимый. Поэтому синтез глюкозы из ацетил-КоА невозможен. Обычно ацетил-КоА далее превращается 2-мя путями: 1) ацетильная группа ацетил-КоА окисляется до СО2 и Н2О через ЦТК и сопряженные цепи переноса электронов с выделением и запасанием энергии в виде АТФ; 2) используется для синтеза кетоновых тел, холестерола и жирных кислот.
Пируватдегидрогеназный комплекс регулируется методом фосфорилирования-дефосфорилирования. Повышение величин отношений НАДН/НАД+, ацетил-КоА/КоА или АТФ/АДФ способствует фосфорилированию фермента протеинкиназой и дезактивации комплекса. Следовательно, пируватдегидрогеназный комплекс инактивируется, если клетка богата энергией и биосинтетическими предшественниками.
Пируват и АДФ, наоборот, активируют пируватдегидрогеназный комплекс посредством ингибирования протеинкиназы.
Вазопрессин активирует пируватдегидрогеназный комплекс путем повышения концентрации ионов кальция в митохондриях, которые активируют протеинфосфатазу (дефосфорилирование фермента). Инсулин также усиливает превращение пирувата в ацетил-КоА через дефосфорилирование пируватдегидрогеназного комплекса.
Цикл трикарбоновых кислот
Вторым компонентом общего пути катаболизма является ЦТК. Этот цикл был открыт в 1937 г. Кребсом и Джонсоном. В 1948 г. Кеннеди и Ленинджер доказали, что ферменты ЦТК локализованы в матриксе митохондрий.
4.1. Химизм цикла трикарбоновых кислот. Свободную уксусную кислоту невозможно окислить путем дегидрирования. Поэтому она в активной форме (ацетил-КоА) предварительно связывается с оксалоацетатом (ЩУК, щавелевоуксусной кислотой), в результате чего образуется цитрат.
1. Ацетил-КоА соединяется с оксалоацетатом в реакции альдольной конденсации, катализируемой цитратсинтазой. Образуется цитрил-КоА. Цитрил-КоА при участии воды гидролизуется до цитрата и НS-КоА.
2. Аконитат-гидратаза(а конитаза) катализирует превращение цитрата в изоцитрат через стадию цис-аконитовой кислоты. Аконитаза по механизму действия одновременно гидратаза и изомераза.
3. Изоцитратдегидрогеназа катализирует дегидрирование изолимонной кислоты в оксалосукцинат (щавелевоянтарную кислоту), которая затем декарбоксилируется в 2-оксоглутарат (α-кетоглутарат). Коферментом является НАД+ (в митохондриях) и НАДФ+ (в цитозоле и митохондриях).
4. 2-Оксоглутаратдегидрогеназный комплекс (α-кетоглутаратдегидрогеназный комплекс) катализирует окислительное декарбоксилирование 2-оксоглутарата в сукцинил-КоА. Мультиферментный 2-оксоглутаратдегидрогеназный комплекс похож на пируватдегидрогеназный комплекс и процесс протекает аналогично окислительному декарбоксилированию пирувата.
5. Сукцинилтиокиназа катализирует расщепление сукцинил-КоА на янтарную кислоту и кофермент А. Энергия расщепления сукцинил-КоА накапливается в виде гуанозинтрифосфата (ГТФ). В сопряженной реакции перефосфорилирования АДФ фосфорилируется в АТФ, а освобождающиеся молекулы ГДФ могут вновь фосфорилироваться (субстратное фосфорилирование). У растений фермент специфичен к АДФ и АТФ.
6. Сукцинатдегидрогеназа катализирует превращение сукцината в фумаровую кислоту. Фермент стереоспецифичен, является интегральным белком, так как вмонтирован во внутреннюю мембрану митохондрий и в качестве простетических групп содержит ФАД и железосерные белки. ФАДН2 не отделяется от фермента, а два электрона далее передаются на кофермент Q цепи переноса электронов внутренней мембраны митохондрий.
7. Фумарат-гидратаза (фумараза) катализирует превращение фумаровой кислоты в яблочную (малат) с участием воды. Фермент стереоспецифичен, образует только L-малат.
8. Малатдегидрогеназа катализирует окисление яблочной кислоты в оксалоацетат. Кофермент малатдегидрогеназы - НАД+. Далее оксалоацетат вновь конденсируется с ацетил-КоА и цикл повторяется.
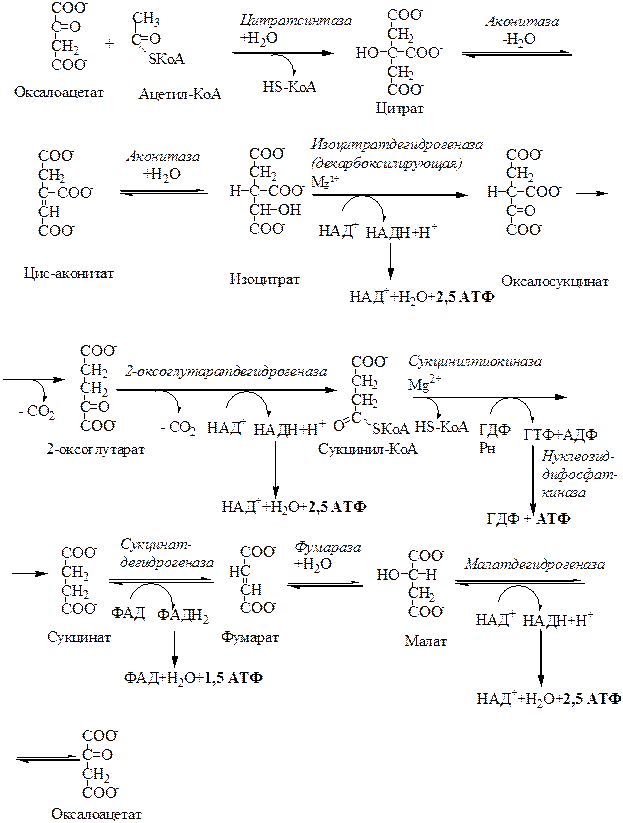
4.2. Биологическое значение и регуляция цикла трикарбоновых кислот. Цикл трикарбоновых кислот – компонент общего пути катаболизма, в котором происходит окисление топливных молекул углеводов, жирных кислот и аминокислот. Большинство топливных молекул поступают в ЦТК в виде ацетил-КоА (рис. 1). Все реакции ЦТК протекают согласованно в одном направлении. Суммарная величина DG0¢ = -40 кДж/моль.
В среде врачей давно бытует крылатая фраза «Жиры горят в пламени углеводов». Ее надо понимать как окисление ацетил-КоА, основным источником которого является β-окисление жирных кислот, после конденсации с оксалоацетатом, образуемой, главным образом, из углеводов (при карбоксилировании пирувата). При нарушениях обмена углеводов или голодании создается дефицит оксалоацетата, ведущий к уменьшению окисления ацетил-КоА в ЦТК.

Рис.1. Роль ЦТК в клеточном дыхании. 1 стадия (ЦТК) извлечение из молекулы ацетил-КоА 8 электронов; 2 стадия (цепи переноса электронов) восстановление двух молекул кислорода и формирование протонного градиента (~36 Н+); 3 стадия (АТФ-синтаза) использование энергии протонного градиента для образования АТФ (~9 АТФ) (Berg J.M., Tymoczko J.L., Stryer L. Biochemistry. N-Y: W.H.Freeman and Company, 2002).
Основная метаболическая роль ЦТК может быть представлена в виде двух процессов: 1) серия окислительно-восстановительных реакций, в результате которых ацетильная группа окисляется до двух молекул СО2; 2) четырехкратное дегидрирование, ведущее к образованию 3 молекул НАДН+Н+ и 1 молекулы ФАДН2. Кислород необходим для функционирования ЦТК опосредованно как акцептор электронов в конце цепей переноса электронов и для регенерации НАД+ и ФАД.
Основное значение для регуляции ЦТК имеет синтез и гидролиз АТФ.
1. Изоцитратдегидрогеназа аллостерически активируется АДФ путем повышения сродства фермента к субстрату. НАДН ингибирует этот фермент, замещая НАД+. АТФ также ингибирует изоцитратдегидрогеназу. Важно, что превращения метаболитов в ЦТК требуют на нескольких стадиях НАД+ и ФАД, количество которых достаточно только в условиях низкого энергетического заряда.
2. Активность 2-оксоглутаратдегидрогеназного (α-кетоглутаратдегидрогеназного) комплекса регулируется аналогично регуляции пируватдегидрогеназного комплекса. Этот комплекс ингибируется сукцинил-КоА и НАДН (конечными продуктами превращений, катализируемых 2-оксоглутаратдегидрогеназным комплексом). Кроме того, 2-оксоглуттаратдегидрогеназный комплекс ингибируется высоким энергетическим зарядом клетки. Итак, скорость превращений в ЦТК уменьшается при достаточной обеспеченности клетки АТФ (рис. 11.2). У ряда бактерий цитратсинтаза аллостерически ингибируется АТФ посредством повышения Км для ацетил-КоА.
Схема регуляции общего пути катаболизма представлена на рисунке 2.

Рис. 2. Регуляция общего пути катаболизма. Основными молекулами, регулирующими функционирование ЦТК являются АТФ и НАДН. Основными пунктами регуляции являются изоцитратдегидрогеназа и 2-оксоглутаратдегидрогеназный комплекс.






