1. Водород находится в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляют по формуле:
P = P атм − P 1 − P 2,
где Р 1 – давление столба воды в бюретке, Па, Р 1 = 9,8 hd aq, 9,8 – переводной коэффициент из мм вод.ст. в Па; d aq – плотность воды, равная 1 г/см3; Р 2 – давление насыщенного водяного пара, которое находят по таблице.
Зависимость давления насыщенного водяного пара от температуры
| Т, К | ||||||
| Р 2, Па | 1226,4 | 1706,2 | 2332,7 | 3172,5 | 4238,9 | 5625,3 |
2. Массу выделившегося водорода m H вычисляют по уравнению Менделеева–Клапейрона:
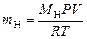 ,
,
где М Н – молярная масса водорода, г/моль; V – объем водорода, м3; R – универсальная газовая постоянная, равная 8,314 Дж/моль·К.
3. Вычислить эквивалент металла по закону эквивалентов:
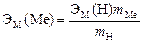 ,
,
где ЭМ(Н) – эквивалентная масса водорода, равная 1 г/экв
4. По степени окисления металла, указанной преподавателем, определить молярную массу металла. Установить, что это за металл.
5. Вычислить точное значение эквивалентной массы металла и найти относительную погрешность эксперимента:
 .
.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные
5. Обработка экспериментальных данных.
6. Вывод.
Лабораторная работа № 4. Определение энтальпии реакции нейтрализации
Цель работы: ознакомиться с принципами и практическими приемами определения теплового эффекта реакции нейтрализации. Измерение теплового эффекта реакции основано на первом начале термодинамики. Для определения теплового эффекта реакции необходимо знать теплоемкость системы Сcal и вызванное реакцией изменение температуры D Т.
Общие сведения
Реакция нейтрализации представляет взаимодействие оснований с кислотами, например, NaOH + HCl = NaCl + H2O. В ионной форме должна быть выражена уравнением H+ + OH− = H2O. Образование из ионов Н+ и OH− молекул воды сопровождается выделением значительного количества тепла.
Сильные кислоты и сильные основания в достаточно разбавленных растворах диссоциированы полностью, поэтому общий тепловой эффект реакции нейтрализации для них обусловлен образованием молекул воды из ионов и теплота процесса должна быть близка к стандартной теплоте нейтрализации, вычисленной по закону Гесса.
Слабые кислоты и основания в растворе представлены преимущественно молекулами. Значение теплоты нейтрализации может существенно отличаться от стандартного значения. В этом случае процесс можно разделить на стадии: диссоциация слабого электролита, гидратация ионов  и собственно нейтрализация
и собственно нейтрализация 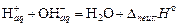 . Тепловой эффект реакции является суммой перечисленных процессов и к теплоте нейтрализации сильного электролита
. Тепловой эффект реакции является суммой перечисленных процессов и к теплоте нейтрализации сильного электролита  следует добавить эндотермический эффект диссоциации слабого электролита
следует добавить эндотермический эффект диссоциации слабого электролита 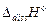 и экзотермический эффект гидратации катиона и аниона
и экзотермический эффект гидратации катиона и аниона  :
:
 .
.
Выполнение работы
1. Собрать упрощенный калориметр из двух вложенных друг в друга стаканов: внутренний стакан (емкостью 100-150 мл) поставить на пористую пробку на дне наружного (емкостью 300-400 мл). Поместить во внутренний стакан стеклянную палочку и термометр с ценой деления 0,1°С.
2. Во внутренний стакан калориметра налить мерным цилиндром 25 мл раствора исследуемой кислоты V K концентрацией 0,5 М.
3. Поставить внутренний стакан в калориметр.
4. Поместить в раствор кислоты термометр с ценой деления 0,1°С.
5. Измерить температуру кислоты с точностью до 0,1 °С.
6. Мерным цилиндром отмерить 25 мл щелочи.
7. Вылить щелочь в кислоту и осторожно, но быстро перемешать раствор.
8. Измерить температуру полученного раствора с точностью до 0,1 °С.
Содержание протокола лабораторной работы
1. Название кислоты и ее химическая формула
2. Объем раствора кислоты, взятый для опыта V К = ………….мл
3. Концентрация раствора кислоты С К = ………………….экв/л
4. Название сильного основания и его химическая формула
5. Объем раствора щелочи, взятый для опыта V Щ = ………….мл
6. Концентрация раствора щелочи С Щ = ………………..экв/л
7. Температура раствора начальная Т 1 = ……………°С
8. Температура раствора конечная Т 2 = …………..°С






