Введение
Методические указания предназначены для курсантов, слушателей и студентов Ивановского института ГПС МЧС России. В издании сведены воедино все необходимые расчетно-аналитические зависимости для решения задач по курсу «Теория горения и взрыва», что способствует усовершенствованию процесса преподавания дисциплины.
В методических указаниях приведены правила составления уравнения реакции горения, основные определения, формулы для расчета материального и теплового баланса процесса горения, расчета показателей пожарной опасности веществ и материалов, классификация веществ по коэффициенту горючести, классификация жидкостей по пожарной опасности. Указана литература, рекомендуемая при изучении дисциплины «Теория горения и взрыва».
Реакция горения
Уравнение материального баланса процесса горения
При составлении уравнения реакции горения необходимо соблюдать четыре правила.
1. Принимают, что происходит полное сгорание вещества, следовательно, в качестве продуктов горения образуются высшие оксиды составляющих его элементов: CO2, SO2, P2O5, H2O. При горении галогенсодержащих углеводородов выделяются: HCl, HF, HBr.
2. Азот при температуре горения ниже 2000 оС не вступает в реакцию. Поскольку в условиях реального пожара температура не превышает значения 1500 – 1600 оС, то принимают, что азот выделяется в свободном виде (N2).
3. Расстановка коэффициентов в схеме реакции горения проводится на один моль горючего вещества.
4. Кислород, входящий в состав горючего вещества (например, C2H6OS 2-тиолэтанол), участвует в реакции горения, как и кислород воздуха, в качестве окислителя.
C2H6OS + 4O2 + 4×3,76N2 ® 2CO2 + 3H2O + SO2 + 4×3,76N2
горючее воздух продукты горения
вещество
b = 4
Коэффициент, который стоит в реакции горения перед кислородом, называется стехиометрическим коэффициентом реакции горения и обозначается греческой буквой b. Так как в результате реакции горения получаются вполне определенные продукты горения, то есть соединения, в которых элементы имеют строго определенные и постоянные степени окисления, можно записать общее уравнение реакции горения:
СcHhOoSsРpHalhalNn + b (O2 + 3.76 N2) = c CO2 + s SO2 +  Р2О5 + hal HHal +
Р2О5 + hal HHal + 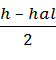 H2O + (3.76 b +
H2O + (3.76 b +  ) N2 (1.1.1)
) N2 (1.1.1)
Стехиометрический коэффициент реакции горения в этом случае можно рассчитать по формуле:
b =  (1.1.2)
(1.1.2)
Горючесть и коэффициент горючести веществ
По горючести вещества и материалы классифицируют на горючие, трудногорючие, негорючие [1].
Негорючие (несгораемые)– вещества и материалы, не способные к горению в воздухе.
Трудногорючие (трудносгораемые)– вещества и материалы, способные гореть в воздухе при воздействии источника зажигания, но не способные самостоятельно гореть после его удаления.
Горючие (сгораемые) – вещества и материалы, способные самовозгораться, а также возгораться при воздействии источника зажигания и самостоятельно гореть после его удаления.
Горючесть вещества оценивается по коэффициенту горючести, обозначаемому буквой К, который рассчитывается по формуле:
К = 4nC + 4nS + nH + nN – 2nO – 2nCl – 3nF – 5nBr, (1.2.1)
где:
nC, nS, nH, nN, nO, nCl, nF, nBr - число атомов соответственно углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К £ 0 – вещество негорючее, 0 < К £ 2 - вещество трудногорючее, К > 2 – вещество горючее.






