4 Вспомогательные ферменты биологического окисления К ним относятся такие ферменты как католаза и пероксидаза. которые играют защитную роль разрушая перекись водорода или органические перекиси образующихся в ходе окислительных процессах Перекиси представляют собой достаточно агрессивные соединения которые могут вызвать значительные изменения в клеточных структурах
ФУНКЦИИ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ
1 Важнейшей функцией биологического окисления является несомненно высвобождение энергии которая в дальнейшем используется в эндоорганических процессах
2 В ходе окисления питательных веществ образуется ряд низкомолекулярных соединений, которые клетка использует потом для биосинтеза Назыв - пластическая функция Например синтез аминокислот из продуктов окисления глюкозы или жиров используется в биосинтетических реакциях Генерация восстановительных эквивалентов (потенциалов).
Окислительные процессы несут защитную роль Многие ксенобиотики обезвреживаются путем окисления в том числе многие лекарственные препараты
5. Огромная роль в поддержании температуры тела Таким образом существование живых существ невозможно без окислительных процессов..
3. Ферменты биологического окисления в митохондриях. НАД- и ФАД-зависимые дегидрогеназы. Цитохромы.
Компоненты дыхательной цепи во внутренней мембране михохондрий формируют комплексы:
I комплекс (НАДН-КоQН2-редуктаза) – принимает электороны от митохондриального НАДН и транспортирует их на КоQ. Протоны транспортируются в межмембранное пространство. Промежуточным акцептором и переносчиком протонов и электронов являются ФМН и железосерные белки. I комплекс разделяет поток электронов и протонов.
II комплекс – сукцинат – КоQ - редуктаза – включает ФАД- зависимые дегидрогеназы и железосерные белки. Он транспортирует электроны и протоны от флавинзависимых субстратов на убихинон, с образованием промежуточного ФАДН2.
Убихинон легко перемещается по мембране и передает электроны на III комплекс.
III комплекс – КоQН2 - цитохром с - редуктаза – имеет в своем составе цитохромы b и с1, а также железосерные белки. Функционирование КоQ с III комплексом приводит к разделению потока протонов и электронов: протоны из матрикса перекачиваются в межмембранное пространство митохондрий, а электроны транспортируются далее по ЦТД.
IV комплекс – цитохром а - цитохромоксидаза – содержит цитохромоксидазу и транспортирует электроны на кислород с промежуточного переносчика цитохрома с, который является подвижным компонентом цепи.
Существует 2 разновидности ЦТД:
Полная цепь – в нее вступают пиридинзависимые субстраты и предают атомы водорода на НАД-зависимые дегидрогеназы
Неполная (укороченная или редуцированная) ЦТД в которой атомы водорода передаются от ФАД-зависимых субстратов, в обход первого комплекса.
Никотинзависимые дегидрогеназы, содержащие в качестве коферментов НАД+ или НАДФ+ . НАД+ и НАДФ+ - производные витамина РР. Субстраты, от которых происходит отщепление (дегидрирование) протонов Н+ и ē на НАД- и НАДФ- зависимые дегидрогеназы находятся в цитоплазме и в матриксе митохондрий. Рабочей частью НАД и НАДФ служит никотинамид (вит. РР). В окисленной форме никотинамидные коферменты обозначают как НАД+ или НАДФ+ , так как они несут положительный заряд на атоме азоте пиридинового кольца. В реакциях дегидрирования из двух атомов водорода, отщепляемых от окисляемого субстрата, никотинамидное кольцо присоединяет ион водорода и два электрона, второй ион водорода переходит в среду.
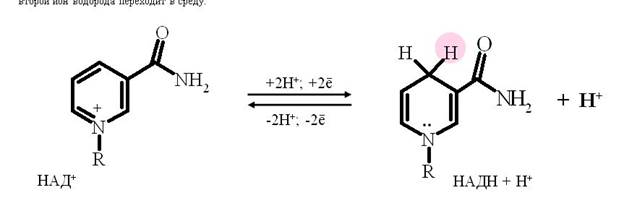
НАД+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ.
Субстратами, отдающими протоны Н+ и электроны на НАД-зависимые дегидрогеназы, являются: изоцитрат, α-кетоглутарат, малат, ПВК, глутаминовая кислота (глутамат) и др.
НАДФН не является непосредственным донором ЦПЭ, а используется исключительно в восстановительных биосинтезах.
Флавиновые дегидрогеназы содержат в качестве простетических групп ФАД или ФМН. Рабочей частью ФАД и ФМН является витамин В2, к которому присоединяются от окисляемого субстрата два протона Н+ и два электрона
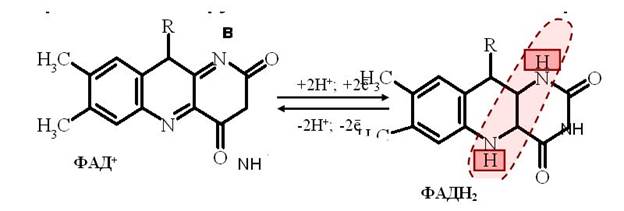 . Большинство ФАД-зависимых дегидрогеназ – растворимые белки, локализованные в матриксе митохондрий. Они являются акцепторами протонов Н + и электронов от субстратов: ацил-КоА, глицерол-3-фосфат и др.
. Большинство ФАД-зависимых дегидрогеназ – растворимые белки, локализованные в матриксе митохондрий. Они являются акцепторами протонов Н + и электронов от субстратов: ацил-КоА, глицерол-3-фосфат и др.
Исключение составляет сукцинат-фумарат дегидрогеназа, находящаяся во внутренней мембране митохондрий. Это II комплекс в ЦПЭ. Она является акцептором протонов Н+ и электронов от субстрата – янтарная кислота (сукцинат).
Цитохромы — это гемопротеины — белки, содержащие в качестве прочно связанной простетической группы гем. Атом железа в геме может менять валентность, присоединяя или отдавая электроны. В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно—восстановительного потенциала следующим образом: B, С1, С, а, а3. Гемовые группы цитохромов связаны с белковой частью донорно—акцепторными связями между ионом железа и соответствующими аминокислотными остатками. В цитохромах С и С1 дополнительные ковалентные связи формируются между тиогруппами цистеина и боковыми винильными группами гема. QН2—дегидрогеназа (комплекс III) представляет собой комплекс цитохромов b и С1. Этот фермент катализирует окисление восстановленного кофермента Q и перенос электронов на цитохром С. Электроны последовательно переносятся атомами железа цитохромов b и С1, а затем поступают на цитохром С. Протоны после окисления QH2 освобождаются в раствор.
Билет№4
Ферментативный катализ






