Основные теоретические положения
Уравнение состояния и критическая точка.
Цель работы: изучение поведения реального газа (этана, С2Н6) и представление результатов исследования в PV-диаграмме.
Между молекулами реальных газов действуют как силы взаимного притяжения, так и силы отталкивания. При весьма малых расстояниях превалируют силы отталкивания, с увеличением расстояний начинают преобладать силы притяжения. Поэтому молекулы реального газа обладают потенциальной энергией, величина которой закономерно изменяется в зависимости от расстояния между ними.

Рис.1.
Характер рассмотренной кривой показывает, что без большой погрешности левую ветвь ее, соответствующую области действия силы отталкивания, можно заменить вертикальной прямой, расположенной на расстоянии d0 от оси ординат (рис. 1). Это означает, что силу отталкивания можно считать бесконечно большой, а сами молекулы — твердыми упругими шариками с диаметром do.
Иначе это же самое можно представить так, что каждая молекула окружена упругой сферической оболочкой, недоступной для проникновения в нее других молекул (а также и сферических оболочек, окружающих эти молекулы).
Значение потенциальной энергии взаимодействия всех
молекул, содержащихся в 1 кг реального газа, можно получить, разбив все
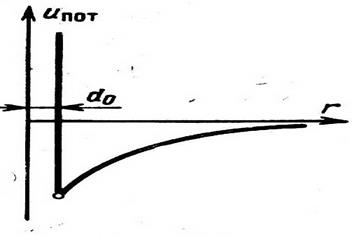
Рис.2.
молекулы на пары и сложив потенциальные энергии парных взаимодействий всех возможных пар. Очевидно, что это значение зависит от среднего расстояния между молекулами и, следовательно, от удельного объема газа. Таким образом, в противоположность внутренней энергии идеального газа, которая не зависит от объема, у реального газа внутренняя энергия является функцией удельного объема, а следовательно, давления.
Уравнение Ван-дер-Ваальса и его анализ.
Уравнение состояния реальных газов, в основу которого были положены упрощенные, но правильные по существу представления о молекулярно-кинетических свойствах и строении этих газов, было получено в 1873 г. Ван-дер-Ваальсом и носит его имя. Это уравнение имеет вид:
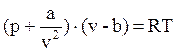 (1)
(1)
где постоянные а и b зависят от природы газа и у различных газов значительно отличаются друг от друга.
Структура уравнения Ван-дер-Ваальса показывает, что за основу его было взято уравнение состояния идеальных газов pv = RT, а затем в него были внесены поправки на объем и давление, которые должны быть приняты во внимание при изучении реальных тазов.
Одна поправка учитывает объем, недоступный для движения молекул в силу конечности объема самих молекул и наличия взаимодействия между ними. Дело в том, что при беспредельном сжатии газа его объем будет стремиться не к нулю, как у идеальных газов, а к некоторому предельно малому объему b. Величина b больше суммарного объема молекул, так как в связи с наличием сил отталкивания, возникающих при их сближении, молекулы газа при сжатии его не могут быть доведены до соприкосновения. Вокруг каждой молекулы существует как бы сферическая оболочка, в пределы которой не могут проникнуть другие молекулы. Величина b является суммарным объемом таких оболочек и составляет примерно учетверенный объем самих молекул. В связи с этим в уравнение состояние следует вводить не полный объем газа v, а лишь свободный объем v—b.
Другая поправка учитывает силы взаимного притяжения, действующие в направлении действия внешнего давления и как бы увеличивающие его на некоторую добавочную величину, называемую внутренним давлением. Полагая, что внутреннее давление газа изменяется пропорционально квадрату плотности или обратно пропорционально квадрату удельного объема газа, Ван-дер-Ваальс принял его равным a/v2, где а — коэффициент пропорциональности.
Особенно интересно уравнение Ван-дер-Ваальса тем, что оно качественно отображает главную особенность реальных газов — способность переходить при определенных условиях в жидкое состояние.
Для выявления физического смысла полученных выводов рассмотрим в системе координат р— v изотермы, построенные по уравнению Ван-дер-Ваальса (рис.3).Первый случай имеет место при высоких температурах,
когда изотермы имеют вид кривых гиперболического характера (например, линия1-2). В этом случае

Рис.3
каждому давлению соответствует вполне определенный удельный объем (например, давлению ра соответствует удельный объем va). Это значение удельного объёма и является действительным корнем уравнения Ван-дер-Ваальса, оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии.
Второй случай имеет место при сравнительно низких температурах, когда изотермы имеют два перегиба (например, линия 3-4).
В этом случае между точками е и f находится область, в которой каждому давлению соответствует три значения удельного объема (например, давлению ра соответствуют удельные объемы  , vc и
, vc и  ), которые и являются тремя действительными и различными корнями уравнения Ван-дер-Ваальса.
), которые и являются тремя действительными и различными корнями уравнения Ван-дер-Ваальса.
Участок 3- b соответствует изотермическому сжатию тела, находящегося в газообразном состоянии, причем в точке b оно уже начинает переходить в жидкое состояние. Точка d соответствует такому состоянию тела, когда оно уже полностью превратилось в жидкость, в соответствии с чем участок d- 4 представляет собой изотермическое сжатие жидкости. Точка с соответствует промежуточному двухфазному состоянию тела. Участок кривой b-f. соответствует неустойчивому состоянию переохлажденного пара, а участок d-e — также неустойчивому состоянию перегретой жидкости. Что же касается участка e-f, то он вообще физического смысла не имеет, поскольку в действительности при изотермическом сжатии тело переходит из газообразного в жидкое состояние при (постоянном давлении, т. е. по горизонтальной линии b-d.
Третий случай имеет место при вполне определенной для каждого тела температуре, когда точки b и d, сближаясь с повышением температуры, сливаются в одну точку k, в которой имеет место перегиб соответствующей изотермы, причем касательная к ней в этой точке имеет горизонтальное направление.
Точка к называется критической точкой, а соответствующие ей параметры ркр, vкр и Tкр называются критическими параметрами.
Критическая температура, существование которой было открыто в 1861 г. Д. И. Менделеевым, характеризуется тем, что при температурах выше нее невозможно путем изотермического сжатия добиться перехода газа в жидкое состояние.
 (2)
(2)
 (3)
(3)
Критические параметры р и T обычно определяются экспериментально (определение v Kр опытным путем ненадежно), а по ним можно определить постоянные а и b в уравнении Ван-дер-Ваальса для данного газа.
Уравнение Ван-дер-Ваальса можно представить в виде зависимости между безразмерными приведенными параметрами


Уравнение Ван-дер-Ваальса в безразмерном или, как иногда говорят, в приведенном виде показывает, что если у разных газов два приведенных параметра имеют одинаковое значение, то одинаковым будет и третий приведенный параметр. Например, если приведенные давления и температуры двух разных газов равны, то равны и их приведенные удельные объемы.
Состояния разных газов, при которых их приведенные параметры π, φ и τ равны, называются соответственными состояниями. Следовательно, если два приведенных параметра у разных газов равны, то эти газы находятся в соответственных состояниях. Это положение, представляющее собой общую закономерность в изменении состояния реальных газов (в предположении, что они подчиняются уравнению Ван-дер-Ваальса), носит название закона соответственных состояний.
Реальные газы, находящиеся в соответственных состояниях, являются термодинамически подобными. Это означает, что при одинаковых π, φ и τ свойства всех газов в отношении давления, удельного объема и температуры идентичны. Иными словами, если из данных эксперимента известны свойства какого-либо реального газа, то по ним без всякого эксперимента можно определить аналогичные свойства любого другого газа, находящегося с ним в соответственном состоянии.
Лабораторная установка и порядок выполнения работы

Ход работы:
Включить электронагреватель с термостатом 1, с помощью регулятора 2 установить нужную температуру. Опыт начинаем тогда, когда температура достигла нужного значения на термометре 5 и стабилизировалась. Значения температур для опытов должны находиться в пределах от 10 до 35 градусов и задаются преподавателем.
С помощью вентиля 3 необходимо выставить нужный объём (шкала 4) и снять показания манометра 6.
Результаты занести в протокол. В графе "Результаты наблюдений" необходимо отмечать моменты появление жидкой фазы этана. Опыт начинать со значения объема 2,5. Шаг изменения принять 0,5 – 0,25 см3 до момента появления жидкого этана и 0,1 – 0,05 см3 после. Опыт заканчивается при достижении предельного давления на манометре.
Опыт необходимо провести 3 раза при разных температурах.
Обработка полученных данных и оформление отчета.
По формулам (2) и (3) рассчитать коэффициенты a и b для уравнения Ван-дер-Ваальса. Молекулярная масса этана – 30,1 кг/кмоль, параметры критической точки приведены на рис.4. Используя формулу (1) рассчитать давление, используя в качестве аргументов значения удельного объема и температуры, полученные в ходе эксперимента. Расчетные данные заносятся в другую таблицу той же формы.
В масштабе на одной диаграмме построить в PV координатах три изотермы по экспериментальным данным и три изотермы, полученные в результате расчетов.

Рис.4 Примеры различных изотерм для этана.
Протокол к лабораторной работе “Уравнение состояния реальных газов”.
| № опыта | t 1= | t 2= | t 3= | ||||||
| V | P | Результат наблюдений | V | P | Результат наблюдений | V | P | Результат наблюдений | |
Лабораторная работа






