Детерминанта - фактор или элемент, обусловливающий то или иное явление, реч.Determinans - определяющий
¨ Зависимость фильтрации от структуры мембран (эпителий слизистых оболочек, эндотелий капилляров, ГЭБ, плацента)
· через водные каналы цитоплазматической мембраны нет постоянного однонаправленного движения воды, ряд авторов считают, что через водные каналы гидрофильные полярные вещества проникают путем пассивной диффузии по градиенту концентрации (пассивная диффузия в водной фазе).
· однако диаметр водных каналов цитоплазматической мембраны очень мал - 0,4 нм, поэтому большинство ЛВ через эти каналы не проходят.
· фильтрацией называют также прохождение воды и растворенных в ней веществ через межклеточные промежутки: путем фильтрации через межклеточные промежутки проходят гидрофильные полярные вещества;
· степень их фильтрации зависит от величины межклеточных промежутков.
 Механизмы переноса ЛС через эпителиальные барьеры:
Механизмы переноса ЛС через эпителиальные барьеры:
1) Эпителий тонкой кишки – содержит много каналов, заполненный жидкостью, через которые могут поступать гидрофильные вещества с очень малой молекулярной массой.
2 ) В желудке эпителиальные клетки плотно прилегают друг к другу, каналов, заполненных жидкостью, нет;
· всасывание в желудке не имеет большого значения, т.к. вещества быстро из него эвакуируются.
¨ Основной отдел, в котором всасываются ЛС – тонкий кишечник. Для него характерна:
1) большая поверхность;
2) эпителий, через который легко проникает жидкость в соответствии с разностью осмотического давления, обусловленной присутствием пищи;
· липофильные неполярные вещества проникают в основном путем диффузии в липидах.
· также в слизистых имеются специальные протеины-переносчики, способные транспортировать вещества против градиента концентрации с затратой энергии (активный транспорт).
* в ЖКТ гидрофильные полярные соединения всасываются плохо. Например:
▪ гидрофильное полярное соединение неостигмин (прозерин) под кожу вводят в дозе 0,0005 г, а для получения сходного эффекта при приеме внутрь требуется доза 0,015 г.
· Особенность для ЛС, всасывающихся со слизистой языка и щек: ЛС избегает пресистемной элиминации.
 Особенности переноса лекарств в структуры мозга и через плаценту:
Особенности переноса лекарств в структуры мозга и через плаценту:
¨ прохождение многих ЛС через гематоэнцефалический барьер затруднено, что связано с особенностями строения капилляров мозга:
1) эндотелий сосудов мозга не имеет пор образует барьер (гематоэнцефалический), который препятствует проникновению гидрофильных полярных веществ из крови в мозг, легко проходят липофильные неполярные вещества путем пассивной диффузии.
2 наличие глиальных элементов (астроглии), выстилающих наружную поверхность эндотелия и служащих дополнительной липидной мембраной.
▪ пиноцитоз отсутствует
▪ ЛС проникают в основном путем диффузии, иногда — за счет активного транспорта;
▪ имеются отдельные небольшие участки головного мозга, в которых гематоэнцефалический барьер практически неэффективен (область эпифиза, задней доли гипофиза, хориоидное сплетение, медианное возвышение, гидрофильные полярные вещества могут проникать в триггер-зону рвотного центра)
· при некоторых патологических состояниях (воспалении) проницаемость гематоэнцефалического барьера повышается.
· Плацентарный барьер:
¨ не имеет водных пор;
¨ хорошо пропускает липофильные соединения путем диффузии;
· полярные вещества (четвертичные аммониевые соли и т.д.) через плаценту проникают плохо.
· В эндотелии сосудов периферических тканей (мышцы, подкожная клетчатка, внутренние органы) межклеточные промежутки достаточно велики и большинство гидрофильных полярных ЛВ легко проходят через них путем фильтрации.
▪ при в/венном введении эти вещества быстро проникают в ткани;
▪ при п/кожном, в/мышечном введении вещества проникают из тканей в кровь и распространяются по организму.
· фильтрация не является основным путем абсорбции лекарств.
¨ ИТОГ:
Таким образом, детерминанты переноса ЛС через водные пространства:
· физико-химические свойства вещества (растворимость в воде и липидах, ионизация, поляризуемость)
· структура барьеров
· кровоток
2.2. Диффузия ЛВ через липидные барьеры. Движущая сила, условия и ограничения переноса.
· растворимость в липидной и водной фазах (коэффициент распределения масло/вода), уравнение диффузии Фика;
· роль градиента концентрации;
· роль макромолекулярных лигандов плазмы и тканей.
¨ Липидная диффузия:
¨ основной механизм переноса через клеточные мембраны – диффузия в липидах.
¨ движущая сила диффузии в липидах – броуновское движение.
¨ главный показатель подвижности ЛВ - коэффициент распределения «масло/вода», так как он определяет, как легко лекарство проникает через липидные мембраны из водной среды.
Основные условия для осуществления диффузии в липидах:
а) градиент концентрации
б) растворимость в липидах (гидрофобность, неполярность – определяется коэффициентом распределения «масло/вода»).
Детерминанта переноса (факторы определяющие перенос):
· очень низкая растворимость вещества в воде (препятствует проникновению в водную фазу).
· легко диффундируют неполярные соединения (АН, В), трудно – ионы (А-, ВН+).
¨ липидная диффузия представляет собой процесс растворения лекарства в липидах мембраны и движение через них;
¨ этот путь абсорбции также подчиняется закону Фика, но он не зависит от размеров ЛВ, а определяется лишь их липофильностью;
¨ В случае липидной диффузии главный показатель подвижности ЛВ - коэффициент распределения «масло/вода», он определяет, как легко лекарство проникает через липидные мембраны из водной среды.
¨ наиболее липофильными являются незаряженные молекулы;
 роль ионизации и рН среды в переносе ЛВ через барьеры, уравнение Гендерсона-Гассельбальха;
роль ионизации и рН среды в переносе ЛВ через барьеры, уравнение Гендерсона-Гассельбальха;
¨ перенос через биологические барьеры веществ с переменной ионизацией:
¨ Количественную зависимость процесса ионизации лекарства при различном рН среды позволяет получить уравнение Гендерсона - Гассельбальха (Henderson-Hasselbach):
¨ иными словами, степень ионизации разбавленной кислоты или основания определяется pKa ЛС (коэффициент ионизации) и pH его окружающей среды согласно уравнению Гендерсона-Гессельбаха:
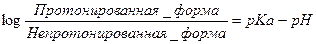 , где pKa соответствует значению pH, при котором концентрации ионизированной и неионизированной форм находятся в равновесии.
, где pKa соответствует значению pH, при котором концентрации ионизированной и неионизированной форм находятся в равновесии.
(1) Для разбавленной кислоты, A,
HA ↔ H+ + A-, где:
▪ HA – концентрация протонированной (неионизированной) формы кислоты;
▪ A- - концентрация ионизированной (непротонированной) формы.
(2) Для слабого основания, B,
BH+ ↔ H+ + B, где:
▪ BH+ - концентрация протонированной формы основания,
▪ B - концентрация непротонированной формы.
¨ зная рН среды и рКа вещества, можно по вычисленному логарифму определить:
* степень ионизации лекарства,
* а значит, и степень его всасывания из ЖКТ;
* степень реабсорбции или экскреции почками при разных значениях рН мочи и т. д.
 Влияние ионизации на всасывание и выведение лекарств:
Влияние ионизации на всасывание и выведение лекарств:
¨ В плазме крови, в тканевой жидкости, в клетках различных органов и тканей в физиологических условиях поддерживается pH 7,3-7,4 (кроме желудка, кишечника, мочи, патологически измененных тканей);
¨ рН среды определяет степень ионизации молекул слабых кислот и слабых оснований.
▪ если ЛВ при значениях рН, свойственных средам организма, находится, главным образом, в неионизированном виде, оно лучше растворимо в липидах, чем в воде, и хорошо проникает через биологические мембраны;
▪ если вещество ионизировано, оно плохо проникает через мембраны клеток в различные органы и ткани, но обладает лучшей водорастворимостью;
¨ С элиминацией лекарств аналогично:
▪ если ЛВ гидрофобное, то оно в таком виде не может быть выведено через почки, так как подвергается почти полной реабсорбции;
▪ такое вещество выводится через почки только после перехода в гидрофильную форму (в результате биотрансформации в печени).
 Принципы управления переносом ионогенных веществ:
Принципы управления переносом ионогенных веществ:
1) изменить рН окружающей лекарство среды таким образом, чтобы наибольшая его часть была неионизированна.
2) покрыть лекарство оболочкой, растворяющейся лишь при определенной рН окружающей среды, при которой данное ЛС будет неионизированно.
 Всасывание слабых кислот и оснований в желудке и кишечнике. Возможности управления скоростью всасывания.
Всасывание слабых кислот и оснований в желудке и кишечнике. Возможности управления скоростью всасывания.
¨ все ЛС можно рассматривать как слабые кислоты или слабые основания, которые имеют свои значения константы ионизации (рК);
¨ если значение рН среды равно значению рК лекарства, то 50% его молекул будет находится в ионизированном и 50% в неионизированном состоянии и среда для лекарства будет нейтральной.
¨ В кислой среде (если рН меньше рК), там где имеется избыток протонов, слабая кислота будет находиться в недиссоциированной форме (R-COOH), т.е. будет связана с протоном – протонирована;
*такая форма кислоты незаряжена и хорошо растворима в липидах;
¨ если рН сместиться в щелочную сторону (т.е. рН станет больше рК), то кислота начнет диссоциировать и лишится протона, перейдя при этом в непротонированную форму, которая имеет заряд и плохо растворима в липидах.
¨ В щелочной среде, там где имеется дефицит протонов, слабое основание будет находиться в недиссоциированной форме (R-NH2), т.е. будет непротонировано и лишено заряда;
*такая форма основания хорошо растворима в липидах и быстро абсорбируется;
¨ В кислой среде имеется избыток протонов и слабое основание начнет диссоциировать, связывая при этом протоны и образуя протонированную, заряженную форму основания;
*такая форма плохо растворима в липидах и слабо абсорбируется.
 следовательно, абсорбция слабых кислот протекает преимущественно в кислой среде, а слабых оснований – в щелочной.
следовательно, абсорбция слабых кислот протекает преимущественно в кислой среде, а слабых оснований – в щелочной.
¨ Слабая кислота:
· будет находиться в неионизированной форме в кислом содержимом желудка (рН желудка около 1,5);
· тогда как в щелочной среде тонкого кишечника (рН тонкого кишечника около 5,5) будет происходить ее диссоциация и молекулы кислоты приобретут заряд;
* поэтому, абсорбция слабых кислот будет наиболее интенсивной в желудке;
· в крови, среда достаточно щелочная и всосавшиеся молекулы лекарства перейдут в ионизированную форму;
* фильтр клубочков почек пропускает как ионизированные, так и неионизированные молекулы, поэтому, несмотря на заряд молекулы кислоты будут выводиться в первичную мочу;
· дальнейшая их судьба будет зависеть от реакции мочи:
* если она щелочная (рН=8,0), то кислота останется в ионизированной форме, не сможет реабсорбироваться обратно в кровоток и выделится с мочой;
* если реакция мочи кислая, то лекарство перейдет в неионизированную форму, которая легко реабсорбируется обратно в кровь.
¨ Слабое основание, напротив:
· практически не будет всасываться из желудка, где для него достаточно кислая среда и оно практически полностью ионизировано;
· абсорбция слабых оснований протекает из кишечника;
· в крови молекулы лекарства не будут ионизироваться и поэтому достаточно легко пройдут через барьер почек и выделятся в первичную мочу.
* если реакция мочи щелочная, то, оставаясь неионизированными, молекулы лекарства также быстро подвергнутся реабсорбции;
* если реакция мочи кислая, то за счет ионизации слабое основание приобретет заряд и будет выделяться с мочой.
¨ Таким образом:
· для того чтобы ускорить выведение из организма слабой кислоты мочу необходимо ощелачивать;
· чтобы ускорить выведение слабого основания ее необходимо подкислить.
¨ данный принцип иногда используют при лечении отравлений, для ускорения элиминации токсического вещества с мочой (детоксикация по Попову).
 несмотря на то, что большинство лекарств ионизируется лишь при определенном значении рН среды, можно выделить еще две небольшие группы лекарственных средств:
несмотря на то, что большинство лекарств ионизируется лишь при определенном значении рН среды, можно выделить еще две небольшие группы лекарственных средств:
· ЛС, не имеющие заряда независимо от рН среды (дигоксин, хлорамфеникол) – не имеют групп способных ионизироваться, они высоко липофильны и хорошо проникают через гистогематические барьеры и внутрь клеток;
· ЛС с постоянным зарядом (гепарин, тубокурарин, суксаметоний) – обладают химическими группировками с настолько выраженной ионизацией, что остаются заряженными при любом значении рН.
¨ для осуществления абсорбции ЛС должно быть липофильным, чтобы пройти через мембрану и гидрофильным, чтобы выйти из мембраны в водную фазу.
2.3. Транспорт ЛВ с участием переносчиков в мембранах 2-го и 3-го типов.
¨ этот транспорт осуществляется при помощи особых транспортных молекул, встроенных в мембрану клетки;
¨ как правило в роли переносчиков выступают белки, которые необходимы для поступления в клетку естественных метаболитов;
¨ так могут переноситься ЛВ близкие по структуре к эндогенным молекулам – например, витамины, метотрексат;
¨ транспорт ионов через плазмалемму проходит за счет участия в этом процессе мембранных транспортных белков – пермеаз;
¨ эти белки могут вести транспорт в одном направлении одного вещества (унипорт) или нескольких веществ одновременно (симпорт), или же вместе с импортом одного вещества выводить из клетки другое (антипорт);
* например, глюкоза может входить в клетки симпортно вместе с ионом Na+.
¨ транспорт ионов может происходить по градиенту концентрации - пассивно без дополнительной затраты энергии;
* например, в клетку проникает ион Na+ из внешней среды, где его концентрация выше, чем в цитоплазме.
¨ различают две разновидности транспорта при помощи переносчиков:
· облегченная диффузия – осуществляется по градиенту концентрации при помощи специальных мембранных белков - переносчиков
· активный транспорт – осуществляется против градиента концентрации.
¨ активный транспорт лекарств – перенос ЛВ независимо от градиента концентрации с использованием энергии АТФ,
· характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов.
Характеризуется:
— избирательностью к определенным соединениям
— возможностью конкуренции двух веществ за один транспортный механизм
— насыщаемостью (при высоких концентрациях вещества)
— возможностью транспорта против градиента концентрации
— затратой энергии
¨ специализированный транспорт не подчиняется закону диффузии Фика и не зависит от наличия заряда у лекарственного вещества;
¨ он является насыщаемым процессом – т.е. скорость абсорбции увеличивается лишь до тех пор, пока количество молекул ЛВ не сравняется с количеством переносчиков;
¨ дальнейшего роста скорости абсорбции, несмотря на повышение концентрации лекарства, при этом не происходит.
2.4. Микровезикулярный транспорт.
¨ Эндоцитоз и пиноцитоз - этот вид абсорбции характерен для высокомолекулярных веществ – полипептидов;
¨ при этом лекарство вначале связывается со специальным распознающим компонентом мембраны клетки, а затем возникает инвагинация (впячивание) мембраны и постепенно формируется вакуоль (пузырек – микровизикул, содержащий молекулы лекарства);
¨ вакуоль перемещается по цитоплазме клетки к ее противоположному полюсу, при этом лекарство может выделяться как в цитоплазму клетки, так и с противоположного полюса клетки (путем экзоцитоза).
¨ Эндоцитоз (включая пиноцитоз и фагоцитоз) может быть:
· неспецифическим или конститутивным, постоянным:
▪ так называется потому, что он протекает как бы автоматически и часто может приводить к захвату и поглощению совершенно чуждых или безразличных для клетки веществ, например, частичек сажи или красителей.
· специфическим, опосредуемым рецепторами (рецепторным).
▪ специфический или опосредуемый рецепторами эндоцитоз имеет ряд отличий от неспецифического:
*главное в том, что поглощаются молекулы, для которых на плазматической мембране есть специфические рецепторы, ассоциирующиеся только с данным типом молекул;
*такие молекулы, связывающиеся с белками-рецепторами на поверхности клеток, называют лигандами.
 Перенос лекарств в системе межуточная ткань – кровяное русло. Механизмы, детерминанты и ограничения переноса. Препараты циркулируют в плазме в двух фракциях:
Перенос лекарств в системе межуточная ткань – кровяное русло. Механизмы, детерминанты и ограничения переноса. Препараты циркулируют в плазме в двух фракциях:
а) свободной – только эта форма фармакологически активна
б) связанной с плазменным белком или другим составными частями крови (эритроцитами – например, на эритроцитах переносится пентоксифиллин, а на лейкоцитах - аминокислоты, некоторые макролиды):
1) величина связывания с белками плазмы для разных веществ является переменной и может варьировать от 0 % до 99 % предела
2) только свободные ЛВ проникают через стенки капилляров; высокая степень связывания с белками плазмы может отодвигать наступление эффекта или продлевать продолжительность действия.
3) некоторые плазменные белки связывают много различных препаратов, в то время как другие белки агрегируют только один или ограниченное число (альбумин сыворотки связывает кислые препараты, α1-гликопротеин и липопротеины – основные).
Последствия связывания ЛС с белками плазмы:
а. Уменьшение связывания с белками плазмы приводит к:
— улучшению проникновения ЛВ из плазмы в ткани
— улучшению фильтрации и почечной экскреции ЛВ
— улучшению метаболизму (в т.ч. печенью) ЛВ
б. Связывание ЛС с белками крови:
— препятствует их выходу из кровяного русла и как следствие:
— приводит к снижению его концентрации в тканях и месте действия.
с. Возникновение токсических эффектов (конкуренция разных ЛС за связывание с белками плазмы ® вытеснение одного ЛС другим ® высокий уровень ЛС в плазме ® токсические эффекты).
¨ свободная и связанная фракция находятся в состоянии равновесия: молекулы ЛС быстро (порядка мс) переходят из одной фракции в другую.
¨ Терапевтический эффект ЛВ в определенной степени зависит от с вязывания их с белками крови и тканей, так какмногие лекарства обладают выраженным ф/х сродством к различным белкам плазмы крови и прежде всего к альбумину;
¨ клиническое значение имеют случаи, когда с белками крови связывается более 90% лекарственного вещества.
¨ нарушение связывания лекарств наблюдается при гипоальбуминемии, при некоторых заболеваниях печени и почек.
3. Пути поступления лекарств в организм.
· энтеральные (перорально, сублингвально, трансбуккально, ректально, через зонд), их достоинства и недостатки; пресистемная элиминация лекарств;
· парентеральные (п/кожно, в/мышечно, в/венно, в/артериально, субарахноидально, в/костно, в полость, ингаляционно, трансдермально и др.), их преимущества и недостатки;
· местное применение лекарств.
Две основные цели введения ЛС:
1) для системного действия
2) для местного действия
 Пути введения лекарств в организм:
Пути введения лекарств в организм:
1. Для системного действия
а. Энтеральный путь введения:
- внутрь (per os) - перорально
- сублингвально
- ректально
- через зонд (например, в 12-ти перстную кишку)
б. Парентеральный путь введения: внутривенно, подкожно, внутримышечно, ингаляционно, субарахноидально, трансдермально.
2. Для местного воздействия:
- накожно (эпикутарно)
- на слизистые
- в полости (брюшную, плевральную, суставную)
- в ткани (инфильтрация)
¨ Применяя различные пути введения ЛС можно:
а) обеспечить разную скорость развития эффекта и его различную продолжительность у одного и того же ЛС
б) увеличить концентрацию препарата в органе-мишени (бронходилятаторы - ингаляторно)
в) уменьшить пресистемную элиминацию ЛС
г) уменьшить выраженность нежелательных лекарственных реакций (ЛС, раздражающие слизистую желудка вводить парентерально и т.д.)
 Сравнительная характеристика. Факторы, обуславливающие выбор пути введения и лекарственной формы.
Сравнительная характеристика. Факторы, обуславливающие выбор пути введения и лекарственной формы.
¨ энтеральные пути введения (enteros – кишечник) обеспечивают введение ЛС в организм через слизистые оболочки ЖКТ;
¨ всасывание ряда веществ (например, кислоты ацетилсалициловой, барбитуратов и других слабых электролитов, имеющих кислый характер) происходит частично из желудка (в кислой среде желудка эти соединения находятся в основном в неионизированной (липофильной) форме и всасываются путем диффузии);
¨ однако подавляющее большинство ЛС всасывается, главным образом, в тонкой кишке;
¨ этому благоприятствует значительная всасывающая поверхность слизистой оболочки кишечника (примерно 200 м2) и ее интенсивное кровоснабжение.
¨ К энтеральным путям введения относят:
 Оральное введение (внутрь, per os) – введение лекарства в организм путем проглатывания:
Оральное введение (внутрь, per os) – введение лекарства в организм путем проглатывания:
· при этом лекарство попадает вначале в желудок и кишечник, где в течение 30-40 мин происходит его всасывание в систему воротной вены;
· далее с током крови лекарство поступает в печень, затем в нижнюю полую вену, правые отделы сердца и, наконец, малый круг кровообращения;
· пройдя малый круг лекарство по легочным венам достигает левых отделов сердца и, с артериальной кровью, поступает к тканям и органам-мишеням;
 этим путем чаще всего вводят твердые и жидкие лекарственные формы (таблетки, драже, капсулы, растворы, пастилки и др.).
этим путем чаще всего вводят твердые и жидкие лекарственные формы (таблетки, драже, капсулы, растворы, пастилки и др.).
| Преимущества метода | Недостатки метода |
| · Наиболее физиологический метод введения ЛВ, удобен и прост. · Не требуется специально обученный персонал для введения. · Метод безопасен. | · Медленное поступление ЛС в системный кровоток. · Скорость всасывания непостоянна и зависит от наличия пищи в ЖКТ, его моторики (если моторика снижается, скорость всасывания падает). · На принятые внутрь ЛС воздействуют ферменты желудка и кишечного сока, метаболические ферментные системы печени, которые разрушают часть вещества еще до того, как оно проникнет в системный кровоток. (Например, при приеме внутрь разрушается до 90% нитроглицерина). · Невозможно применять лекарства, которые плохо всасываются в ЖКТ (например, антибиотики аминогликозиды) или разрушаются в нем (инсулин, альтеплаза, гормон роста). · ЛС может вызвать язвенное поражение ЖКТ (например, кортикостероиды, салицилаты). · Этот путь введения неприемлем при отсутствии у пациента сознания (хотя лекарство можно ввести сразу в/желудочно через зонд), если у пациента неукротимая рвота или опухоль (стриктура) пищевода, имеются массивные отеки (анасарка, т.к. при этом нарушается процесс всасывания лекарства в кишечнике). |
 Пресистемная элиминация — исчезновение вещества из организма до его попадания в систему кровообращения:
Пресистемная элиминация — исчезновение вещества из организма до его попадания в систему кровообращения:
¨ эта элиминация осуществляется в процессе прохождения вещества через стенку кишечника, при первом (first pass elimination) прохождении через печень и легкие.
¨ интенсивность пресистемной элиминации — один из параметров, который определяет величину биодоступности или биоусвоения вещества;
¨ некоторые ЛС настолько быстро элиминируют до всасывания в кровь, что их либо совершенно нерационально назначать через рот (лидокаин), либо надо назначать внутрь в дозе, существенно превышающей таковую при парентеральном введении (салбутамол, тербуталин, верапамил, анаприлин и пр.);
¨ в стенке кишечника (а также в легких, почках и некоторых других тканях) обнаружены те же ферментные системы, что и в печени, только их активность значительно меньше, чем в ней.
¨ в стенке кишечника осуществляется биотрансформация ЛС с участием и монооксигеназных систем, и ферментов, образующих парные эфиры;
¨ в итоге в стенке кишки возникают полярные соединения, хуже всасывающиеся, чем исходное вещество, и выводящиеся с фекалиями;
¨ чем интенсивнее функционируют названные ферментные системы, тем меньше всасываются принятые через рот лекарства, и наоборот;
¨ у детей первых месяцев жизни активность этих ферментов, участвующих в биотрансформации ЛС в кишечнике (как и в других тканях), еще недостаточна: это уменьшает образование полярных метаболитов и способствует всасыванию принятых лекарств из кишечника.
¨ из кишечника вещество попадает в воротную вену, а затем в печень, где оно может быть захвачено ее клетками и подвергнуться биотрансформации, что препятствует попаданию вещества в систему кровообращения;
¨ из печени вещество попадает в нижнюю полую вену и вместе с кровью направляется в правое сердце, а из него — в легкие.
 Ректальный путь (per rectum) – введение лекарства через анальное отверстие в ампулу прямой кишки.
Ректальный путь (per rectum) – введение лекарства через анальное отверстие в ампулу прямой кишки.
¨ этим путем вводят мягкие ЛС (суппозитории, мази) или растворы (при помощи микроклизмы);
· всасывание вещества осуществляется в систему геморроидальных вен: верхней, средней и нижней;
· из верхней геморроидальной вены вещество попадает в систему воротной вены и проходит через печень, после чего оно поступает в нижнюю полую вену;
· из средней и нижней геморроидальных вен лекарство поступает сразу в систему нижней полой вены, минуя печень;
¨ ректальный путь введения часто применяется у детей первых трех лет жизни.
| Преимущества метода | Недостатки метода |
| · Часть лекарства избегает метаболизма в печени, сразу поступая в системный кровоток. · Можно использовать у пациентов с рвотой, стриктурами пищевода, массивными отеками, нарушением сознания. · На лекарство не действуют пищеварительные ферменты. | · Психологический фактор: данный путь введения может не нравиться или чрезмерно нравиться пациенту. · Возможно раздражающее действие лекарства на слизистую оболочку прямой кишки. · Ограниченная поверхность абсорбции. · Непостоянная скорость всасывания и степень всасывания лекарственного средства. Зависимость абсорбции от наличия фекальных масс в кишке. · Требуется специальное обучение пациента технике введения. |
Сублингвальное (под язык) и суббукальное (в полость между десной и щекой) введение.
¨ таким способом вводят твердые ЛФ (таблетки, порошки), некоторые из жидких форм (растворы) и аэрозоли.
· при этих способах введения ЛС всасывается в вены слизистой оболочки ротовой полости;
· далее последовательно поступает в верхнюю полую вену, правые отделы сердца и малый круг кровообращения;
· после этого лекарство доставляется в левые отделы сердца и с артериальной кровью поступает к органам мишеням.
| Преимущества метода | Недостатки метода |
| · На лекарство не действуют пищеварительные ферменты желудка и кишечника. · полностью избегает первичного печеночного метаболизма, поступая сразу в системный кровоток. · Быстрое начало действия, возможность управлять скоростью всасывания лекарства (за счет посасывания или разжевывания таблетки). · Действие лекарства можно прервать, если лекарство выплюнуть. | · Можно вводить только высоко липофильные вещества: морфин, нитроглицерин, клонидин, нифедипин или вещества с высокой активностью, т.к. площадь абсорбции ограничена. · Избыточное выделение слюны при рефлекторной стимуляции механорецепторов полости рта может спровоцировать заглатывание лекарства. |
Парентеральное введение – путь введения лекарственного средства, при котором оно поступает в организм, минуя слизистые оболочки желудочно-кишечного тракта.
º Инъекционное введение.
¨ при этом пути введения лекарство сразу попадает в системный кровоток, минуя притоки воротной вены и печень;
¨ к инъекционному введению относят все способы, при которых повреждается целостность покровных тканей;
¨ осуществляются при помощи шприца и иглы;
¨ основное требование к данному пути введения – обеспечение стерильности ЛС и асептического выполнения инъекции.
1. Внутривенное введение.
¨ при этом способе введения игла шприца прокалывает кожу, гиподерму, стенку вены и лекарство непосредственно вводится в системный кровоток (нижнюю или верхнюю полые вены);
¨ лекарство может вводиться струйно медленно или быстро (болюсом), а также капельным способом;
¨ таким образом вводят жидкие ЛФ, которые являются истинными растворами или лиофилизированные порошки (предварительно растворив их).
| Преимущества метода | Недостатки метода |
| · Непосредственное введение лекарства в кровь и практически мгновенное развитие эффекта. · Высокая точность дозирования. · Можно вводить вещества, которые обладают раздражающим действием или являются гипертоническими растворами (в количестве не более 20-40 мл). · Можно вводить вещества, которые разрушаются в ЖКТ. | · Невозможно вводить масляные растворы, эмульсии и суспензии, если они не прошли специальной обработки. · Очень сложная техника манипуляции, которая требует специально обученного персонала. · В органах с хорошим кровоснабжением могут создаваться токсические концентрации вещества в первые минуты после введения. · Возможно инфицирование и воздушная эмболия при неправильной технике. |
2. Внутримышечное введение.
¨ данным путем вводят все виды жидких ЛФ и растворы порошков;
¨ иглой шприца прокалывают кожу, гиподерму, фасцию мышцы и затем ее толщу, куда и впрыскивают лекарство;
¨ абсорбция лекарства происходит в систему полых вен;
¨ эффект развивается через 10-15 мин;
¨ объем вводимого раствора не должен превышать 10 мл;
¨ при в/мышечном введении лекарство всасывается менее полно, по сравнению с в/венным введением, но лучше, чем при пероральном применении.
| Преимущества метода | Недостатки метода |
| · Можно вводить масляные растворы и эмульсии, а также депо-препараты, которые обеспечивают сохранение эффекта несколько месяцев. · Сохраняется высокая точность дозирования. · Можно вводить раздражающие вещества, т.к. ткани мышц не содержат много рецепторов. | · Требуется специально обученный персонал для выполнения инъекции. · Возможно повреждение сосудисто-нервных пучков при выполнении инъекции. · Невозможно удалить депо-препарат, если требуется прекращение лечения. |
3. Подкожное введение.
¨ данным путем вводят жидкие ЛФ любого вида и растворимые порошки;
¨ игла шприца прокалывает кожу и входит в гиподерму, лекарственное вещество после введения всасывается сразу в систему полых вен.
¨ эффект развивается через 15-20 мин;
¨ объем раствора не должен превышать 1-2 мл.
| Преимущества метода | Недостатки метода |
| · Эффект сохраняется дольше, чем при внутривенном или внутримышечном введении этого же лекарства. · Можно вводить лекарства, которые разрушаются в ЖКТ. | · Всасывание происходит достаточно медленно из-за низкой скорости кровотока. Если периферическое кровообращение нарушено, то эффект может не развиться вообще. · Нельзя вводить вещества, которые обладают раздражающим действием и сильные сосудосуживающие средства, т.к. они могут вызывать некроз. · Риск инфицирования раны. · Требуется специальное обучение пациента или помощь персонала. |
¨ из парентеральных путей наиболее распространенными являются введение веществ под кожу, в мышцу и в вену;
¨ особенно быстро наступает эффект при внутривенном введении, несколько медленнее при внутримышечном и подкожном введении;
¨ для пролонгирования фармакотерапевтического эффекта ЛВ вводят в мышцу в малорастворимом виде (взвесь) в масле или других основах, задерживающих всасывание веществ из места введения.
¨ в/мышечно и подкожно не следует вводить вещества, обладающие выраженным раздражающим действием, так как это может быть причиной воспалительных реакций, инфильтратов и даже некроза.
¨ в/венно ЛС вводят обычно медленно:
▪ возможно однократное, дробное, капельное введение и инфузия;
▪ в/венно нельзя вводить нерастворимые соединения, масляные растворы (возможность эмболии), средства с выраженным раздражающим действием (могут привести к развитию тромбоза, тромбофлебита), препараты, вызывающие свертывание крови или гемолиз.
Отрицательными чертами указанных трех путей введения являются их относительная сложность, а также болезненность, необходимость стерильности препаратов, участия медицинского персонала.
· в/артериальное введение позволяет создать в области, которая; кровоснабжается данной артерией, высокие концентрации вещества.
▪ таким путем иногда вводят противоопухолевые средства;
▪ для уменьшения их общего токсического действия отток крови может быть искусственно затруднен (путем пережатия вен);
▪ в/артериально вводят также рентгеноконтрастные препараты, что позволяет точно определить локализацию опухоли, тромба, сужения сосудов, аневризмы.
4. Интратекальное введение – введение лекарственного вещества под оболочки мозга (субарахноидально или эпидурально).
¨ выполняют путем инъекции вещества на уровне L4-L5 поясничных позвонков;
¨ при этом игла прокалывает кожу, гиподерму, межостистые и желтые связки отростков позвонков и подходит к оболочкам мозга;
· при эпидуральном введении лекарство поступает в пространство между костным каналом позвонков и твердой оболочкой мозга;
· при субарахноидальном введении игла прокалывает твердую и паутинную оболочки мозга и лекарство вводится в пространство между тканями мозга и мягкой мозговой оболочкой;
¨ объем вводимого лекарства не может превышать 3-4 мл.
¨ при этом необходимо удалить соответствующее количество ликвора;
¨ вводят только истинные растворы.
| Преимущества метода | Недостатки метода |
| · Создается высокая концентрация лекарства в тканях мозга и ликворе. · Можно вводить средства, которые не проникают через ГЭБ. | · Чрезвычайно сложная техника инъекции. · Риск травмы тканей мозга и перепадов внутричерепного давления. · Невозможно обеспечить введение неистинных растворов (суспензий, эмульсий). |
 Ингаляционное введение – введение ЛВ путем вдыхания его паров или мельчайших частиц;
Ингаляционное введение – введение ЛВ путем вдыхания его паров или мельчайших частиц;
¨ данным путем вводят газы (закись азота), летучие жидкости, аэрозоли и порошки;
¨ легкие — это обширная абсорбционная зона (90 - 100 м2), получающая обильное кровоснабжение, поэтому всасывание веществ при их ингаляции происходит быстро.
¨ глубина введения аэрозолей зависит от величины частиц:
· частицы диаметром более 60 мкм оседают в глотке и проглатываются в желудок;
· частицы диаметром 40-20 мкм проникают в бронхиолы, а частицы диаметром 1 мкм достигают альвеол;
▪ лекарство проходит через стенку альвеолы и бронхов и попадает в капилляр;
▪ затем с током крови поступает в левые отделы сердца и, по артериальным сосудам, доставляется к органам мишеням.
¨ выраженностью эффекта легко управлять, изменяя концентрацию вещества во вдыхаемом воздухе;
¨ скорость всасывания зависит: от объема дыхания, активной поверхности альвеол и их проницаемости, растворимости веществ в крови и скорости тока крови.
| Преимущества метода | Недостатки метода |
| · Быстрое развитие эффекта в связи с хорошим кровоснабжением и большой поверхностью абсорбции (150-200 м2). · В случае заболевания дыхательных путей лекарство доставляется непосредственно в очаг поражения и можно уменьшить вводимую дозу лекарства и, следовательно, вероятность развития нежелательных эффектов. | · Необходимо использовать специальные ингаляторы для введения лекарственного вещества. · Требуется обучение пациента синхронизации дыхания и ингаляции лекарства. · Нельзя вводить лекарства, оказывающие раздражающее действие или вызывающие бронхоспазм. |
 Трансдермальное введение – аппликация на кожу лекарственного вещества для обеспечения его системного действия.
Трансдермальное введение – аппликация на кожу лекарственного вещества для обеспечения его системного действия.
¨ используют специальные мази, кремы или TTS (трансдермальные терапевтические системы – пластыри).
¨ некоторые препараты (обычно высоколипофильные) всасываются и оказывают резорбтивное действие при нанесении их на кожу (например, нитроглицерин);
¨ трансдермальные лекарственные формы получают все большее распространение, так как с их помощью удается длительно поддерживать стационарную концентрацию веществ в плазме крови.
| Преимущества метода | Недостатки метода |
| · Можно обеспечить длительное и равномерное поддержание концентрации лекарственного вещества в организме за счет его медленной абсорбции. · Лекарственное вещество всасывается через кожу в систему нижней или верхней полой вены минуя печень и не подвергаясь в ней первичному метаболизму. | · Медленное начало действия и непостоянная скорость абсорбции лекарства (зависит от места аппликации и вида лекарственной формы). · Можно вводить только высоко липофильные вещества. |
 Местное нанесение.
Местное нанесение.
- накожно (эпикутарно)
- на слизистые
- в полости (брюшную, плевральную, суставную)
¨ включает аппликацию лекарства на кожу, слизистые оболочки глаз (конъюнктиву), носа, гортани, влагалища с целью обеспечения высокой концентрации лекарства в месте нанесения, как правило, без системного действия.
¨ выбор пути введения лекарства зависит от его способности растворяться в воде или неполярных растворителях (маслах), от локализации патологического процесса и степени тяжести заболевания.
· при легкой и средней степени тяжести заболеваний путь введения, как правило, – пероральный, ректальный, интраназальный, сублингвальный, ингаляционный, местный аппликационный, реже внутримышечный, тогда как при тяжелом течении заболеваний – внутримышечный и внутривенный.
4. Главные состовляющие фармакокинетики: биодоступность, распределение, клиренс.
4.1. Понятие биодоступности, способ определения. Биодоступность и качество препаратов.
Биодоступность лекарств: сущность, детерминанты, зависимость от пресистемной элиминации и качества лекарственной формы.
¨ параметром, который характеризует абсорбцию лекарств является биодоступность.
¨ Биодоступность (F) – полнота и скорость всасывания при внеситемных путях введения
¨ биодоступность показывает, какая часть от введенной дозы лекарства поступила в системный кровоток и характеризует скорость с которой это происходит.
¨ для оценки биодоступности строят кривую зависимости концентрации ЛВ в крови от времени после его введения внутривенно, а также после введения исследуемым путем;
¨ это т.н. фармакокинетическая кривая зависимости «время-концентрация»;
¨ путем интегрирования находят значения площади под фармакокинетической кривой и рассчитывают биодоступность как отношение:
 ≤ 1, где AUC – площадь под фармакокинетической кривой.
≤ 1, где AUC – площадь под фармакокинетической кривой.
¨ биодоступность отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата.
Детерминанты биодоступности:
1) скорость всасывания
2) полнота всасывания - недостаточная абсорбция ЛС вследствие его очень высокой гидрофильности или липофильности, метаболизма бактериями кишечника при энтеральном введении и т.д.
3) пресистемная элиминация – биотрансформация в печени (в основном)
¨ при высокой пресистемной элиминации биодоступность ЛС низкая (нитроглицерин при энтеральном введении);
¨ биодоступность определяется и качеством лекарственной формы, например, использование сублингвальных таблеток и ректальных суппозиториев помогает ЛС избежать пресистемной элиминации.
¨ биодоступность > 70% считается высокой, ниже 30% - низкой.
· считают, что биодоступность составляет 100% для ЛС, которые вводят внутривенно;
· при введении другими путями биодоступность обычно меньше из-за неполной абсорбции, частичного метаболизма в периферических тканях;
· при пероральном введении лекарства его биодоступность во многом зависит от ЛФ – лекарство лучше всасывается из растворов и мелкодисперсных взвесей, чем из таблеток, драже и капсул.
· традиционно считается, что биодоступность при внутримышечном и внутривенном введении всегда выше, чем при введении любым другим путем;
· однако, из этой закономерности есть и исключения:
▪ при внутривенном введении хлорамфеникола сукцината его биодоступность ниже, чем после введения внутрь. Это связано с тем, что гидролазы, которые высвобождают хлорамфеникол из эфира более активны в ЖКТ, чем в крови.
▪ при внутримышечном введении фенитоина и диазепама биодоступность ниже, чем при пероральном – это связано с тем, что в тканях мышц часть этих ЛС образует неабсорбирующиеся преципитаты.
4.2.Распределение лекарств в организме:
· основные отсеки распределения, лиганды лекарств, детерминанты распределения.
¨ Распределением лекарственных средств называют процесс его распространения по органам и тканям после того, как он поступит в системный кровоток;
¨ именно распределение лекарств обеспечивает его попадание к клеткам-мишеням;
¨ универсальная особенность распределения большинства ЛС – неравномерность.
¨ Отсеки распределения:
1. Внеклеточное пространство (плазма, межклеточная жидкость)
2. Клетки (цитоплазма, мембрана органелл)
3. Жировая и костная ткань (депонирование ЛС)
¨ Молекулярные лиганды ЛС:
а) специфические и неспецифические рецепторы
б) белки крови (альбумин, гликопротеин) и тканей
в) полисахариды соединительной ткани
г) нуклеопротеиды (ДНК, РНК)
¨ распределение лекарств зависит от следующих факторов:
· природы ЛВ – чем меньше размеры молекулы и липофильнее лекарство, тем быстрее и равномернее его распределение.
· размеров органов – чем больше размер органа, тем больше ЛС может поступить в него без существенного изменения градиента концентраций Например:
*объем скелетных мышц очень велик, поэтому концентрация лекарства в них остается низкой даже после того, как произошла абсорбция значительного количества лекарства;
*напротив, объем головного мозга ограничен и поступление в него даже небольшого количества лекарства сопровождается резким повышением его концентрации в ткани ЦНС и исчезновению градиента.
· кровоток в органе:
▪ величина кровотока прямо пропорционально определяет распределение ЛС, при этом оно будет накапливаться преимущественно в областях с наиболее интенсивным кровотоком.
*в хорошо перфузируемых тканях (мозг, сердце, почки) терапевтическая концентрация вещества создается значительно раньше, чем в тканях плохо перфузируемых (жировая, костная);
*если ЛС быстро подвергается разрушению, то в плохо перфузируемых тканях его концентрация может так и не повысится.
· наличие гистогематических барьеров (ГГБ) – структура барьеров (совокупность биологических мембран между стенкой капилляра и тканью, которую он кровоснабжает).
▪ если ткань имеет плохо выраженный ГГБ, то лекарство легко проникает через него: такая ситуция имеет место в печени, селезенке, красном костном мозге, где имеются капилляры синусоидного типа (т.е. капилляры, в стенке которых имеются отверстия – фенестры);
▪ напротив, в ткани с плотными ГГБ распределение лекарств происходит весьма плохо и возможно лишь для высоколипофильных соединений.
· связывание лекарства с белками плазмы:
▪ чем больше связанная фракция лекарства, тем хуже его распределение в ткани. Это связано с тем, что покидать капилляр могут лишь свободные молекулы.
· депонирование лекарства в тканях:
▪ связывание лекарства с белками тканей способствует его накоплению в них, т.к. снижается концентрация свободного лекарства в периваскулярном пространстве и постоянно поддерживается высокий градиент концентраций между кровью и тканями.
▪ следует учитывать, что значительные количества вещества могут накапливаться на путях их выведения;
▪ ЛС, циркулирующие в организме, частично связываются, образуя внеклеточные и клеточные депо;
▪ к экстрацеллюлярным депо могут быть отнесены белки плазмы (особенно альбумины), например, ненаркотический анальгетик бутадион связывается с белками плазмы более чем на 90%.
▪ Вещества могут накапливаться:
* в соединительной ткани (некоторые полярные соединения, в том числе четвертичные аммониевые соли), в костной ткани (тетрациклины).
* некоторые препараты (в частности, акрихин) в особенно больших количествах обнаруживаются в клеточных депо. Связывание их в клетках возможно за счет белков, нуклеопротеидов и фосфолипидов.
* жировые депо представляют особый интерес, так как в них могут задерживаться липофильные соединения (например, некоторые средства для наркоза).
▪ депонируются ЛС, как правило, за счет обратимых связей;
▪ продолжительность их нахождения в тканевых депо варьирует в широких пределах: например, некоторые сульфаниламиды (сульфадиметоксин и др.) образуют стойкие комплексы с белками плазмы, с чем частично связана значительная продолжительность их действия; очень длительно задерживаются в организме ионы тяжелых металлов.
▪ следует учитывать, что распределение веществ, как правило, не характеризует направленность их действия:
▪ направленность зависит от чувствительности к ним тканей, т.е. от сродства ЛС к тем биологическим субстратам, которые определяют специфичность их действия.
· объем распределения, размерность и методы определения.
· варианты объема распределения ЛВ, количественное соотношение с анатомическими отсеками и размерами тела
¨ количественной характеристикой распределения лекарства является кажущийся объем распределения (Vd);
¨ кажущийся объем распределения – это кажущееся (мнимое, расчетное) водное пространство, которое должен занять препарат при концентрации равной концентрации в плазме (условно принимается, что концентрации вещества в плазме и других жидких средах организма одинаковы).
¨ 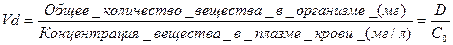 (л, л/кг)– это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови;
(л, л/кг)– это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови;
¨ Т.о. Vd равен отношению введенной дозы (общего количества лекарства в организме) к его концентрации в плазме крови:
 .
.
¨ чем больше кажущийся объем распределения, тем большая часть лекарств распределяется в ткани;
¨ объем распределения дает представление о фракции вещества, находящейся в плазме крови:
▪ для липофильных соединений, легко проникающих через тканевые барьеры и имеющих широкое распределение (в плазме, в интерстициальной жидкости, во внутриклеточной жидкости) характерно высокое значение Vd.
▪ если вещество в основном циркулирует в крови — Vdимеет низкие величины.
¨ данный параметр важен для рационального дозирования веществ, а также для определения константы скорости элиминации (Ke) и периода полувыведения (t1/2).
Детерминанты объема распределения:
1) молекулярная масса ЛС, его ионизация и полярность
2) возраст и пол организма
3) беременность
4) патологические состояния (заболевания печени, почек, ССС)
¨ у человека массой 70 кг объемы жидких сред составляют в целом 42 л. Тогда, если:
▪ Vd=3-4 л, то все лекарство распределено в крови;
▪ Vd<14 л, то все лекарство распределено во внеклеточной жидкости;
▪ Vd=14-48 л, то все лекарство приблизительно равномерно распределено в организме;
▪ Vd>48 л, то все лекарство находится преимущественно во внеклеточном пространстве.
▪ 
Схема 5. Относительная величина различных объемов жидких сред организма, где происходит распределение лекарственных средств у человека массой 70 кг.
¨ кажущийся объем распределения часто применяют при планировании режима дозирования для расчета нагрузочных доз (Dн) и их коррекции.
¨ Нагрузочной называют дозу лекарства, которая позволяет полностью насытить организм ЛС и обеспечить в крови его терапевтическую концентрацию:

4.3 Фармакокинетические модели:
· Однокамерная модель, графическое и математическое описание в нормальных и лог-нормальных координатах;

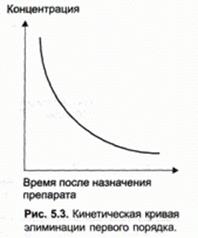
¨ ЛВ мгновенно распределяется после внутривенного введения однократной дозы.
¨ если механизмы для устранения ЛС, таких как биотрансформация печеночными ферментами и почечная секреция, не насыщены при введении терапевтической дозы, логнормальный график изменения плазменной концентрации во времени будет линеен.
¨ элиминация ЛВ происходит согласно кинетики первого порядка – то есть фракция ЛВ, элиминирующая в единицу времени, постоянна.
Наклон лог-нормальной оси -k, где k - постоянная скорости элиминации и имеет размерность время-1.
Плазменная концентрация ЛВ (Ct) в любое время t после введения в организм составляет:
Ln Ct = Ln C0 – kt.
Константа элиминации (k), Vd, и общий клиренс (CL) связаны выражением: CL = k × Vd
 общий вид экспоненциальной кинетики (первого порядка), описывающей процесс элиминации вещества из плазмы крови (для случая однокамерной модели).
общий вид экспоненциальной кинетики (первого порядка), описывающей процесс элиминации вещества из плазмы крови (для случая однокамерной модели).
§ элиминация первого порядка объясняет устранение большинства препаратов;
§ фракция ЛВ, элиминирующая в единицу времени постоянна, то есть изменение концентрации ЛВ в плазме представляет собой линейную функцию;
¨ элиминация первого порядка встречается, когда системы устранения не насыщены лекарственным веществом.
 Кинетика элиминации лекарств нулевого порядка (для случая, когда скорость элиминации не зависит от концентрации препарата в плазме крови).
Кинетика элиминации лекарств нулевого порядка (для случая, когда скорость элиминации не зависит от концентрации препарата в плазме крови).

¨ ЛС с кинетикой элиминации нулевого порядка (кинетики насыщения) характерно то, что скорость элиминации не зависит от концентрации препарата, а, например, ограничена количеством какого-либо фермента, метаболизирующего данное ЛС;
¨ при процессах нулевого порядка период полуэлиминации постоянной величиной не является.
¨ Элиминация нулевого порядка встречается, когда терапевтические дозы препаратов превышают способность (вместимость) механизмов устранения.
· многокамерная модель.
Модель с двумя камерами
¨ иллюстрирует более реальное сочетание механизмов элиминации и уравновешивания с внесосудистой средой;
¨ результирующий график показывает начальную фазу распределения, время, требуемое ЛВ для достижения равновесного состояния между центральной камерой (плазменное пространство) и второй камерой (ткани, поглощающие лекарство и жидкости в которые лекарственное вещество распределяется);
¨ за фазой распределения следует медленная фаза элиминации первого порядка.

¨ Для препаратов, которые удовлетворяют условиям двухкамерной модели, значение С0, получается экстраполяцией фазы элиминации до пересечения с осью ординат;
¨ С0 используется для вычисления объема распределения и константы элиминации.
¨ Формулы для расчета Сt и CL, приведенные для однокамерной модели, также применяются в течение фазы элиминации для препаратов, которые удовлетворяют условиям модели с двумя камерами.
4.4. Клиренс – понятие размерность, метод определения. Общий клиренс и его составляющие. Выражение через параметры Vd, t1/2, Kel.
¨ Клиренс (Cl, мл/мин) – объем крови, который очищается от ЛС за единицу времени.
¨ поскольку плазма (кровь) выступает как «видимая» часть объема распределения, то, иными словами, клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени;
¨ если обозначить общее количество лекарства в организме через Аобщ, а количество, которое выделилось через Авыд, то тогда:
 *.
*.
¨ с другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет Аобщ=Vd´Cтер/плазма. Подставляя это значение в формулу клиренса, мы получим:
 .
.
¨ Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови.
¨ В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (Dп), т.е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне:
Скорость введения = скорость выведения = Cl´Cтер (доза/мин)
Dп = скорость введения´t (t - интервал, между приемом лекарства)
¨ Различают общий клиренс, который отражает сумму всех процессов элиминации лекарства и клиренс каждого из органов элиминации (печени, почек, кожи, легких и др.). Таким образом, Clобщий=Clпочки+ Clпечень+ Clдр. орг.
¨ Клиренс аддитивен, т.е. элиминация вещества из организма может происходить с участием процессов, идущих в почках, легких, печени и других органах: Clсистемный = Clпочечн. + Clпечени + Clдр.
¨ Клиренс ЛС – это отношение скорости элиминации всеми возможными путями к концентрации лекарства в биологической жидкости:

¨ Клиренс – объем плазмы или крови, освобождаемый от вещества за единицу времени (размерность – мл/час; л/час) – главный параметр для управления режимом дозирования.
¨ Клиренс связан с периодом полуэлиминации ЛС и объемом распределения: t1/2= 0,7*Vd/Cl.
4.5. Константа элиминации: сущность, размерность, связь с другими фармакокинетическими параметрам.
¨ Константа элиминации (Ke) – доля (фракция) вещества, элиминируемая за единицу времени.
¨ Ke=CL/Vd;
¨ единицы измерения клиренса: [Ke]=час-1/мин-1=доля в час.
¨ Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения.
4.6. Период полувыведения: сущность, размерность, связь с другими фармакокинетическими параметрами.
¨ Период полувыведения (t1/2) — это время, необходимое для снижения наполовину количества ЛВ в организме в процессе элиминации;
¨ при этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов;
¨ в простейшем случае организм рассматривается как единое целое (камера), имеющее размер, равный VD.
¨ поскольку органы элиминации могут очищать от лекарства только ту кровь или плазму, которая проходит через данный орган, эта кровь или плазма находится в равновесном состоянии с общим объемом распределения;
¨ таким образом, t1/2 будет зависеть как от объема распределения, так и от клиренса:
 или
или
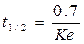
¨ период полувыведения – важнейший фармакокинетический параметр, позволяющий:
а) рассчитать время наступления равновесной концентрации (равно 5 периодам полуэлиминации)
б) определить время полной элиминации препарата
в) предсказать концентрацию ЛС в любой момент времени (для ЛС с кинетикой первого порядка)
Принципы дозирования лекарств. Доза, ее способы и варианты введения.
¨ Дозой называют количество лекарства, предназначенное для введения в организм пациента;
Виды доз:
а) разовая доза – количество вещества на один прием
б) суточная доза - количество препарата, назначаемое на сутки в один или несколько приемов
в) курсовая доза - общее количество препарата на курс лечения
г) ударная доза – кол-во ЛС, достаточное для создания в начале лечения высокой концентрации ЛВ в организме
д) терапевтические дозы - дозы, в которых препарат используют с лечебными или профилактическими целями (пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы).
е) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма.
Также можно выделить 1) загрузочную (вводную) и 2) поддерживающую дозы.
Единицы дозирования ЛС:
1) в граммах или долях грамма ЛС
2) количество ЛС в расчете на 1 кг массы тела (например, 1 мг/кг) или на единицу поверхности тела (например, 1 мг/м2)
Цели дозирования ЛС:
1) определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью
2) избежать явлений интоксикации и побочных эффектов при введении ЛС
¨ доза может вводиться инъекционным способом, т.е. с нарушением целостности кожных покровов и неинъекционным способом (т.е. без нарушения целостности таковых).
¨ возможно 2 варианта введения доз:
¨ Непрерывный, который осуществляют путем длительных внутрисосудистых инфузий (вливаний) лекарства капельным способом или через автоматические дозаторы – инфузоматы;
· при непрерывном введении лекарства, концентрация его в организме изменяется плавно и не подвергается значительным колебаниям.
¨ Прерывистое введение, осуществляется как инъекционным, так и неинъекционным способами и представляет собой введение лекарства через определенные промежутки времени (интервалы дозирования).
· при прерывистом введении лекарства его концентрация в организме непрерывно колеблется.
· после приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства;
· колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
¨ основной целью лекарственной терапии является обеспечение в организме терапевтического уровня лекарства;
¨ для этого используют введение вначале нагрузочной, а затем – поддерживающих доз лекарства;
¨ напомним формулы для расчета этих доз:
Dн=Vd´Cтер
Dп=Cl´Cтер´t, где t - интервал между введениями.
В случае инфузионного введения при расчете поддерживающей дозы множитель t принимают равным 1.
5. Кинетика лекарств в крови при непрерывном введении.
Непрерывное внутрисосудистое введение
¨ единственным принципиальным отличием постоянного введения лекарства в организм от его дискретного назначения является постоянное непрерывное






