Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
-алкилирования;
-нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Одним из важнейших свойств белка является гидролиз – разрушение первичной структуры, который протекает ступенчато:



(сложный белок) + Н2О  полипептид
полипептид  олигопептид
олигопептид 


 дипептид
дипептид  α-АК
α-АК
Белки по составу делятся на:
Простые - протеины (яичный белок – альбумин)
Сложные - протеиды, которые содержат небелковую часть – простетическую группу:
- фосфорную кислоту – фосфопротеины
- углевод – гликопротеины
- нуклеотиды – нуклеопротеины
- липид – липопротеины
- металл – металлопротеины.
Качественные реакции на белки
1) Биуретовая реакция (на все белки)
Белок + СuSO4 + NaOH  яркое фиолетовое окрашивание
яркое фиолетовое окрашивание
 СuSO4 + 2NaOH
СuSO4 + 2NaOH  Cu(OH)2
Cu(OH)2  + Na2SO4
+ Na2SO4
голубой осадок

OH H  OH
OH







 С = О: Cu: O = C
С = О: Cu: O = C  C = O: N
C = O: N






 Cu
Cu 
N  H OH N: O = C
H OH N: O = C




растворимый комплекс
ярко фиолетового цвета
2) Ксантопротеиновая реакция (для белков, имеющих в составе АК с ароматическим радикалом)
T
белок + HNO3 (k)  осадок жёлтого цвета
осадок жёлтого цвета
Н O H O
| || --H2O | ||
 N
N  CH
CH  C─ + HONO2
C─ + HONO2 
 N
N  CH
CH  C─
C─
| |
CH2 CH2
|

 жёлтого цвета
жёлтого цвета
Если добавить концентрированный раствор аммиака, то появляется оранжевое окрашивание, так как в нитробензоле происходит смещение электронной плотности.
3) Цистеиновая реакция - реакция на остаток АК, содержащий S

Белок + NaOH + Pb(CH3COO)2  PbS + белок
PbS + белок
Чёрный цвет



| |
SH + Pb2+  S
S
SH |
 | Pb + PbS
| Pb + PbS 
 |
|
S
|

БИОКАТАЛИЗ
Одной из важных черт химических реакций, протекающих в живых организмах, является их каталитическая природа. Живую клетку можно представить как миниатюрный каталитический реактор. Отличие клетки от колбы химика заключается в том, что если в колбе все реакции протекают независимо (осуществляется фундаментальный принцип независимости реакций), то в клетке все происходит взаимосвязано.
Это происходит не потому, что нарушаются физические законы или клетка подчиняется другим законам – нет, в живых материях действуют одни законы. Просто в процессе эволюции природой был создан эффективный аппарат регулирования всех клеточных реакций, который позволяет всей клетке контролировать соотношение продуктов таким образом, чтобы оптимально функционировали все реакции.
Таким образом, все биохимические реакции – это реакции каталитические.
Биологические катализаторы называются ферментами или энзимами.
В принципе, в клетке протекают те же химические реакции, что и в химической лаборатории, но на условия протекания реакций в клетке накладываются жёсткие ограничения, а именно T = 37◦С и P = 1 атм.
Поэтому часто процессы, которые в лаборатории протекают в 1 стадию, в живых клетках в осуществляются в несколько стадий.
Сущность каталитических реакций, несмотря на многообразие, сводится к тому, что исходные вещества, образуют с катализатором промежуточное соединение, которое относительно быстро превращается в продукты реакции, регенерируя катализатор.
Иногда промежуточные соединения можно выделить в чистом виде, но обычно они состоят из неустойчивых молекул, обнаружение которых возможно только с помощью очень чувствительных спектральных приборов.
Процесс с участием катализатора – циклический или круговой.
Мера активности фермента – число оборотов (число молей субстрата, претерпевающих изменение за 1 минуту в расчёте на 1 моль фермента)
Число оборотов может достигать 108.
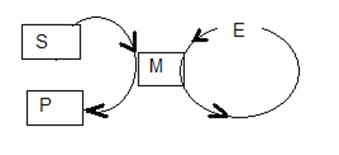
Довольно часто циклы работы нескольких катализаторов соединяются вместе, образуя круговой процесс.

Вещества S1 и S2 превращаются в продукты Р1 и Р2. В ходе этого превращения сначала S1 реагирует с третьим веществом Х и катализатором Е1, образуя промежуточный продукт М1, который в свою очередь при помощи катализатора Е2 превращается в промежуточный продукт М2 и т. д.
Ускоряющее действие катализатора связано с уменьшением энергии активации (это та дополнительная энергия, которая должна быть сообщена одному молю вещества, чтобы частицы вещества стали реакционно способными и могли преодолеть энергетический барьер реакции).
К основным свойствам ферментов относятся:
- эффективность, которая заключается в степени ускорения (ускорение в 100 млн раз).
- повышенная субстратная специфичность. Ферменты отличают субстрат благодаря биологическому узнаванию (комплементарности).
- повышенная специфичность катализируемой реакции. Большинство ферментов ускоряет один тип реакций.
- повышенная специфичность по отношению к оптическим изомерам (могут узнавать левые и правые изомеры).
Причина всех уникальных свойств ферментов - их пространственное строение. Обычно это глобулярные белки, намного превосходящие по размерам субстрат. Это обстоятельство приводит к тому, что в процессе эволюции на поверхности фермента образовался активный центр, который комплементарен субстрату. Это замок и ключ.
Условно активные центры делятся на: связывающие и каталитические.
Связывающий центр связывает субстрат и оптимально ориентирует его по отношению к катализируемой группе, в катализирующем же центре сосредоточены все активные группы.
Если для проведения реакции необходимо провести гидролиз (белков, липидов), то катализируемый центр формируется боковыми радикалами АК – остатков.
В этом случае фермент состоит только из полипептидных цепей. Однако кроме гидролитических реакций протекают и другие: окислительно-восстановительные, реакции переноса каких-либо групп.
В этих случаях в ферментах содержится небелковая часть. Эта часть – кофермент (rофактор, простетическая группа). Белковая часть обеспечивает связывающее действие, а кофермент – каталитическое. Белковая часть – апофермент.
Апофермент + кофермент ↔холофермент






