В данном разделе необходимо ознакомиться с ассимиляцией молекулярного азота, превращением его в нитраты и нитриты, восстановлением последних до аммиака, участием аммиака в биосинтезе аминокислот. Изучите другие пути биосинтеза аминокислот. Особое внимание обратите на процессы переаминирования и ферменты, участвующие в нем. Превращения отдельных аминокислот. Диссимиляция аминокислот: их декарбоксилирование и деаминирование.
Условия, необходимые для биосинтеза белков. Участие ферментов.
Для большей части культивируемых человеком растений источником азота являются аммиак и нитраты почвы. Лишь некоторые из растений способны усваивать непосредственно молекулярный азот атмосферы и превращать его в органические азотистые вещества своего тела. Источником аммиака в почве служат остатки и выделения животных и растений, разлагающиеся в почве под влиянием жизнедеятельности живущих в ней микроорганизмов. Разложение органических азотистых соединений, попадающих в почву с остатками и выделениями растений и животных, происходит таким образом, что, в конце концов, из них образуется аммиак. Процесс разложения в почве белков, аминокислот, мочевины и других органических азотистых соединений получил название аммонификации, а вызывающие его почвенные организмы — аммонификаторов.
Эти микроорганизмы имеют очень активные ферменты. При разложении белков аммонификаторы прежде всего гидролизуют их с помощью мощных протеолитических ферментов, образуя аминокислоты. Свободные аминокислоты подвергаются далее дезаминированию с образованием в итоге аммиака.
Процесс дезаминирования у аммонифакторов в зависимости от условий может происходить по-разному. Простейший путь дезаминирования — гидролитическое дезаминирование, при котором из аминокислоты и воды образуются соответствующая оксикислота и аммиак:
RCHNH2—COOH + H2O→RCHOH—COOH + NH3
Если разложение белков микроорганизмами идет в аэробных условиях, т. е. при доступе кислорода воздуха, то дезаминирование аминокислот приводит к образованию аммиака а соответствующих кетокислот:
RCHNH2—COOH + 1/2 O2 → RCO—COOH + NH3
При восстановительном дезаминировании из аминокислоты получаются аммиак и соответствующая жирная кислота:
RCHNH2—COOH + 2Н+ →RCH2— COOH + NH3
В анаэробных условиях, при которых часто происходит гниение белков, многие микроорганизмы разлагают аминокислоты таким образом, что одна из них окисляется, а другая восстанавливается, причем выделяется аммиак:

Образовавшаяся кетокислота снова вступает в окислительно-восстановительную реакцию еще с одной молекулой исходной аминокислоты. При подобном сопряженном окислительно-восстановительном разложении гликокола и аланина суммарное уравнение процесса имеет следующий вид:
СН3—CHNH2—СООН + 2NH2CH2—COOH→ЗСН3—COOH + 3NH3 + СО2
Аланин Гликокол Уксусная кислота
При анаэробных условиях в почве может происходить также декарбоксилирование аминокислот; образуются амин и диоксид углерода:

Амин далее разлагается бактериями до СО2, воды и аммиака.
Значительное количество аммиака образуется в почве при разложении мочевины, попадающей в почву с навозом и нечистотами. Аммонификация мочевины осуществляется особой группой бактерий — уробактериями. По-видимому, процесс разложения мочевины уробактериями идет таким образом, что наряду с аммиаком образуется аммонийная соль карбаминовой кислоты:

Образовавшаяся аммонийная соль карбаминовой кислоты далее взаимодействует с какой-либо оксикислотой, образующейся в результате жизнедеятельности бактерий, и дает гидрокарбонат аммония и соответствующую аминокислоту. Так, например, взаимодействие с молочной кислотой (обычный продукт жизнедеятельности бактерий) приводит к образованию аланина и гидрокарбоната аммония:

Аммиак, образовавшийся в почве при аммонификации органических азотистых соединений, либо поглощается корневой системой растений, либо подвергается окислению до нитритов и нитратов благодаря жизнедеятельности нитрифицирующих бактерий. Образующиеся при этом нитраты так же, как и аммиак, поглощаются корневой системой и используются растениями для построения аминокислот, белков, нуклеиновых кислот и других азотистых соединений.
Некоторые из живущих в почве микроорганизмов способны усваивать молекулярный азот воздуха и превращать его в аминокислоты и белки. Эти микроорганизмы, открытые в 1894 г. С. Н. Виноградским, играют большую роль в обогащении почвы азотистыми соединениями, а следовательно, в повышении ее плодородия.
Представителями свободноживущих почвенных бактерий, способных ассимилировать азот воздуха, являются анаэробные бактерии Clostridium и аэробные, принадлежащие к роду Azotobacter. Молекулярный азот воздуха могут также связывать некоторые живущие в почве и водоемах микроскопические водоросли, принадлежащие к группе синезеленых водорослей (цианобактерий). Это, например, доказано для синезеленых водорослей, населяющих рисовые поля. Показано также, что молекулярный азот усваивают фотосинтезирующие бактерии, а также лишайники и некоторые высшие растения, содержащие в качестве симбионтов цианобактерий. Во Вьетнаме и Калифорнии на рисовых полях специально разводят водяной папоротник Azolla, в листьях которого живут усваивающие молекулярный азот цианобактерий. Благодаря этому папоротнику рисовые поля обогащаются азотом, и урожайность риса повышается.
С. Н. Виноградский и С. П. Костычев высказали гипотезу, согласно которой первым продуктом усвоения молекулярного азота бактериями является аммиак, который далее вступает в реакции с различными продуктами превращения углеводов и дает аминокислоты. Превращение молекулярного азота в аммиак происходит восстановительным путем, по-видимому, через гидразин:

Впервые Карнаану, а затем другим ученым с помощью бесклеточных экстрактов из разрушенных клеток Azotobacter, Clostridium, Klebsiella и синезеленых водорослей удалось воспроизвести in vitro процесс фиксации азота воздуха и образования из него аммиака.
С глубокой древности известно, что бобовые растения — соя, люцерна, клевер, люпин и т. д. — не нуждаются в азотистых удобрениях и сами обогащают почву азотом. Таким образом, бобовые резко отличаются в этом смысле от всех других растений. Этой способностью они обязаны бактериям, живущим на их корнях в особых желвачках, называемых клубеньками.
Клубеньковые бактерии, будучи выделены из клубеньков в чистую культуру, могут усваивать молекулярный азот лишь тогда, когда в питательной среде присутствуют некоторые метаболиты, например арабиноза, или если в питательной среде присутствует культура растительной ткани. Важным условием является также низкая концентрация кислорода.
Развитие клубеньковых бактерий на корнях бобовых растений — пример симбиоза. Бактерии питаются теми органическими веществами, которые доставляет им высшее растение, асами снабжают последнее азотистыми соединениями, образующимися в результате связывания молекулярного азота атмосферы.
Большой интерес представляет наличие в клубеньках бобовых растений вещества, которое аналогично гемоглобину крови. Как и гемоглобин, это вещество, названное легоглобином, легко присоединяет молекулярный кислород и образует оксилегоглобин: Легоглобин + О2 
 Легоглобин О2 (оксилегоглобин). Это вещество играет очень важную роль в обмене веществ клубеньков и клубеньковых бактерий. Оно содержится только лишь в клубеньках растений, зараженных «эффективными» штаммами клубеньковых бактерий.
Легоглобин О2 (оксилегоглобин). Это вещество играет очень важную роль в обмене веществ клубеньков и клубеньковых бактерий. Оно содержится только лишь в клубеньках растений, зараженных «эффективными» штаммами клубеньковых бактерий.
Обычно клубеньки бобовых содержат около 4% легоглобина на сухое вещество. Легоглобин сои состоит из двух основных компонентов, различающихся по скорости движения при электрофорезе, по форме кристаллов и по аминокислотному составу. Молекулярная масса быстро движущегося компонента равна 16 000, содержание железа составляет 0,34%; медленно движущийся компонент имеет молекулярную массу 15 400 и содержит 0,29% железа. Процесс фиксации азота клубеньками бобовых растений стимулируется молибденом и кобальтом. Усиление фотосинтеза, например, при повышенной концентрации СО2 в воздухе также стимулирует у бобовых растений азотфиксацию. Существенным успехом на пути выяснения химизма фиксации азота бобовыми растениями явились опыты, в которых удалось показать фиксацию в гомогенатах, полученных путем механического разрушения клубеньков. При этом установлено, что азотфиксирующая способность свойственна фракции бактероидов, т. е. клубеньковых бактерий, которые в результате развития в клетках высшего растения сильно изменили свою физиологию и форму. Вместе с тем эти опыты показали, что легоглобин не принимает непосредственного участия в процессе фиксации молекулярного азота, а, активно связывая кислород, создает необходимые для фиксации микроаэрофильные условия в клубеньке и вместе с тем транспортирует к бактероидам кислород, необходимый для их дыхания и синтеза АТР.
Из бесклеточных экстрактов, полученных из различных микробов, усваивающих молекулярный азот, выделен ферментный комплекс — нитрогеназа, который катализирует процесс восстановления азота до аммиака. Нитрогеназа состоит из двух белков — белка I (по прежней терминологии азоферредоксина), содержащего негеминовое железо, и белка II (ранее называвшегося молибдоферредоксином), имеющего в своем составе молибден и негеминовое железо. Белок I — димер с молекулярной массой протомера 27 000—30 000. Он содержит четыре атома железа, связанные с четырьмя атомами сульфидной серы. Белок II — тетрамер с молекулярной массой около 220 000, он включает 24 атома железа, 24 атома серы и 2 атома молибдена.
Нитрогеназа катализирует не только восстановление молекулярного азота до аммиака, но и восстановление ряда других субстратов — ацетилена С2На-до-этилена С2Н4, ионов водорода до молекулярного водорода, оксида азота N2O до Н2О и N2, азида натрия NaN3 до NH3 и Н2.
Восстановление ацетилена в этилен с последующим газохроматографическим определением последнего широко используется в настоящее время как быстрый и весьма чувствительный косвенный метод количественного учета интенсивности фиксации азота.
Для осуществления процесса фиксации молекулярного азота необходимы источник энергии в виде АТР и приток электронов. Их источники у разных азотфиксирующих микроорганизмов различны. У анаэробов, подобных Clostridium pasteurianum, это процесс брожения, сопровождающийся фосфорокластическим расщеплением пировиноградной кислоты и образованием ацетилфосфата:

Ацетилфосфат затем отдает заключенную в нем энергию ADP с образованием АТР, используемого в процессе азотфиксации. Источником электронов, необходимых для восстановления азота, у анаэробов также служит пировиноградная кислота.
У аэробов, подобных азотобактеру и клубеньковым бактериям, источник АТР и электронов — процесс дыхания, а у фотосинтезирующих азотфиксаторов — процесс фотосинтеза. Перенос электронов от их источника к нитрогеназе у всех азотфиксирующих микробов происходит при участии негеминовых железопротеидов (ферредоксинов). «Топливом», используемым в процессе генерации энергии, необходимой для осуществления азотфиксации, и источником углеродных соединений, связывающих образовавшийся аммиак, служат углеводы и полимеры β-оксимасляной кислоты.
Вместе с тем, как указано выше, нитрогеназа катализирует восстановление гидратированных ионов водорода до молекулярного водорода. Этот последний при участии фермента гидрогеназы поглощается клетками микробов-азотфиксаторов, образуя при окислении АТР, необходимый для процесса азотфиксации
Некоторые штаммы клубеньковых бактерий имеют закодированную в плазмиде очень активную гидрогеназу и поэтому интенсивно окисляют молекулярный водород, образующийся под действием нитрогеназы. Такие штаммы при инокуляции бобовых дают гораздо более продуктивные растения, чем обычные штаммы не обладающие или обладающие слабой гидрогеназой.
Образовавшийся при азотфиксации аммиак вступает в реакцию с α-кетоглютаровой кислотой и дает глютаминовую кислоту:
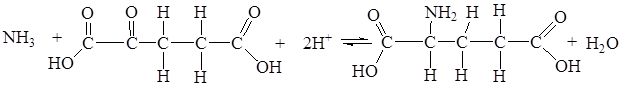
Глютаминовая кислота под влиянием фермента глютаминсинтетазы, связывая затем еще одну молекулу аммиака, дает глютамин. Глютамин, в свою очередь взаимодействуя с α-кетоглютаратом под влиянием фермента глютаматсинтазы, образует две молекулы глютаминовой кислоты. Эта реакция и фермент глютаматсинтаза играют важную роль в усвоении аммиака растениями.
При декарбоксилировании, переаминировании и других превращениях глютаминовая кислота может дать начало γ-аминомасляной кислоте, аспарагину и ряду аминокислот.
В настоящее время выяснена природа ассимилирующих молекулярный азот симбиотических микроорганизмов, развивающихся в корневых клубеньках некоторых кустарников и древесных растений — это актиномицеты.
К числу таких растений принадлежат, например, лох (Eleagnus) и ольха (Alnus). Интересно, что фиксация азота корневыми клубеньками этих растений, так же как и у бобовых, стимулируется кобальтом. Опыты с меченым азотом 15N показали, что в отличие от Azotobacter, Clostridiam и клубеньков бобовых растений, где первыми продуктами ассимиляции молекулярного азота являются глютаминовая кислота, глютамин и аспарагин, в клубеньках ольхи меченый азот обнаруживается в первую очередь не только в глютаминовой кислоте, но и в цитруллине, содержание которого в клубеньках ольхи особенно велико. У сои и вигны важнейшими продуктами фиксации азота являются аллатоин и аллантоиновая кислота.
Вопросы для самопроверки
1.Усвоение азота растениями. Окисление его до нитритов и нитратов.
2.Биосинтез аминокислот растениями.
3.Судьба синтезированных аминокислот.
4.Охарактеризуйте реакции переаминирования, дезаминирования и декарбоксилирования.
Грузинов Евгений Владимирович
Евтушенко Анатолий Михайлович
Крашенинникова Ирина Геннадьевна
Якунина Елена Сергеевна
Панов Валерий Петрович
БИОХИМИЯ






