1. верно 1,3
2. верно 3,4
3. верно 1,2,3
4. верно 3
163. Кислотно-основное титрование в неводных растворителях применяют для количественного определения лекарственных веществ, которые не титруют в воде т.к.:
1. слабые кислотно-основные свойства у ЛВ
2. малая растворимость
3. плохая фиксация конца реакции
4. все выше перечисленное
164. Методом Мора определяют ионы:
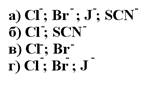
1. а
2. б
3. в
4. г
165. Если …, то рН раствора равен:

1. 9
2. 10
3. 6
4. 4
166. Если …, то среда раствора:
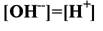
1. кислая
2. нейтральная
3. щелочная
4. слабо-кислая
167. Если …, то концентрация ионов OH(-) моль/л равна:

1. 10 (-3)
2. 10 (-12)
3. 10 (-13)
4. 10 (-10)
168. Фенолфталеин окрашивается в малиновый цвет при значении рН раствора:
1. 10
2. 12
3. 14
4. 11
169. Подвергаются гидролизу соли:

1. а
2. б
3. в
4. г
170. Лакмус в нейтральной среде приобретает окраску:
1. малиновую
2. фиолетовую
3. синюю
4. желтую
171. Значениями рН>7 характеризуются растворы солей:

1. а
2. б
3. в
4. г
172. Метилоранж имеет красный цвет в растворе солей:

1. а
2. б
3. в
4. г
173. Комплексометрическим методом можно определять:

1. а
2. б
3. в
4. г
174. Кислотный хром темно-синий относится к:
1. кислотно-основным индикаторам
2. металлоиндикаторам
3. адсорбционным
4. окислительно-восстановительным
175. Аммиачный буферный раствор добавляют:
1. для поддержания среды
2. для создания кислой среды
3. для разрушения прочности комплекса
4. для создания щелочной среды
176. Использование адсорбционных индикаторов основано на:
1. способности анализируемого аниона адсорбироваться на индикаторе
2. способности анализируемого аниона адсорбировать индикатор
3. способности аниона индикатора адсорбироваться на поверхности коллоидной частицы анализируемого вещества
177. Косвенное титрование - это:
1. когда пользуются двумя титрантами
2. когда титруют остаток первого титранта
3. когда титруют продукт реакции
4. когда титруют навеску
178. Нормальность титрованного 0,05М раствора серебра нитрата равна:
1. 0,1н
2. 0,5н
3. 0,05н
4. 0,2н
179. Фенолфталеин имеет окраску в 0,1н растворе нитрата натрия:
1. малиновую
2. бесцветную
3. розовую
4. желтую
180. Значениями рН<7 характеризуются растворы солей:

1. а
2. б
3. в
4. г
181. Метилоранж имеет желтый цвет в растворах солей:

1. а
2. б
3. в
4. г
182. При комплексометрическом титровании среда должна быть:
1. нейтральной
2. кислой
3. слабо-щелочной
4. щелочной
183. Обратное титрование - это:
1. когда пользуются одним титрантом
2. когда пользуются двумя титрантами
3. когда титруют продукт реакции
4. когда титруют навеску
184. Методом Фольгарда и Фаянса проводят количественное определение вещества:
1. серебра нитрата
2. калия сульфида
3. калия иодида
4. натрия нитрита
185. Методом Мора и Фольгарда можно определить:

1. а
2. б
3. в
4. г
186. Не подвергаются гидролизу соли:

1. а
2. б
3. в
4. г
187. Ионное произведение воды равно:
1. 10 (-12)
2. 10 (-10)
3. 10 (-14)
4. 10 (-8)
188. Титр раствора - это:
1. количество эквивалентов вещества в 1 л раствора
2. количество молей вещества в 1 л раствора
3. количество граммов вещества в 1 мл раствора
4. количество граммов вещества, содержащееся в 100 г раствора
189. Точка эквивалентности - это:
1. момент взаимодействия одинаковых весовых количеств реагирующих веществ
2. момент равенства взаимодействия исходного и конечного продуктов реакции
3. момент взаимодействия эквивалентных количеств реагирующих веществ
190. Эквивалентные массы кислоты, основания и соли в реакции:

1. а
2. б
3. в
4. г
191. Фенолфталеин относится к индикаторам:
1. адсорбционным
2. окислительно-восстановительным
3. кислотно-основным
4. металлоиндикаторам
192. Количественное определение какого вещества проводят методом комплексометрии:
1. цинка хлорид
2. иод
3. натрия тиосульфат
4. калия дихромат
193. До какого цвета титруют в комплексометрии:
1. до белого осадка
2. до точки просветления
3. до цвета свободного индикатора
4. до желтого цвета
194. Хлорид и бромид ионы в методе Мора определяют:
1. прямым титрованием
2. обратным титрованием
3. косвенным титрованием
4. титрованием по остатку
195. В комплексометрии установочным веществом является:

1. а
2. б
3. в
4. г
196. Установочным веществом в алкалиметрии является:
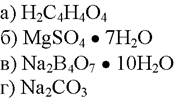
1. а
2. б
3. в
4. г
197. Ацидиметрия - это:
1. количественное определение кислот
2. количественное определение оснований
3. определение качественного состава веществ
4. анализ осадков
198. К металлоиндикаторам относится:
1. трилон Б
2. мурексид
3. флюоресценин
4. эозин
199. Титрантом в методе комплексометрии является:

1. а
2. б
3. в
4. г
200. Индикатор в кислой среде имеющий бесцветную окраску, а в щелочной - малиновую:
1. фенолфталеин
2. лакмус
3. метиловый оранжевый
4. нейтральный красный
201. Ученый основавший ионную теорию индикаторов:
1. Витт
2. Фаянс
3. Оствальд
4. Фольгард
202. Второе название комплексометрии:
1. нитритометрия
2. трилонометрия
3. перманганатометрия
4. иодометрия
203. В методе трилонометрии среда должна быть:
1. сильнощелочная
2. слабощелочная
3. слабокислая
4. нейтральная
204. Комплексометрия - метод, основанный на образовании прочного внутрикомплексного соединения, хорошо растворимого в воде титранта с:
1. 2х зарядными ионами
2. 4х зарядными ионами
3. 2х, 3х, 4х зарядными ионами
4. 2х и 3х зарядными ионами
205. В комплексометрии непрочное комплексное соединение вишнево-красного цвета титруют трилоном Б до:
1. обесцвечивания
2. цвета свободного индикатора
3. осадка
4. желтого окрашивания
206. В основе кислотно-основного метода лежит реакция:
1. окислительно-восстановительная
2. окисления
3. осаждения
4. нейтрализации
207. Метилоранж имеет оранжевый цвет в среде:
1. рН=2
2. рН=3,8
3. рН=4,7
4. рН=4,5
208. Фенолфталеин имеет малиновый цвет в среде:
1. рН=9
2. рН=7
3. рН=5
4. рН=11
209. В титриметрическом анализе V1 означает:
1. объем первого титранта
2. объем пипетки
3. объем мерной колбы
4. объем основного титранта
210. Реакция нейтрализации - это взаимодействие:
1. кислот с солями
2. кислот и оснований
3. оснований с солями
4. кислот и кислот
211. Красная лакмусовая бумажка, опущенная в раствор сульфита калия:
1. покраснеет
2. посинеет
3. пожелтеет
4. не изменит цвет
212. К какому способу титрования относится эта формула:
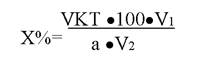
1. прямое
2. обратное
3. прямое с разведением
4. обратное с разведением
213. Результаты титрования не должны отличаться друг от друга более чем:
1. 5 мл
2. 0,4 мл
3. 0,1 мл
4. 0,8 мл
214. Титрование, при котором титруют продукт реакции, является:
1. прямым
2. косвенным
3. обратным
4. прямым с разведением
215. Магния сульфат определяют методом комплексометрии и титруют до:
1. синего цвета
2. желтого цвета
3. розового цвета
4. обесцвечивания раствора
216. Если рН=5, то среда является:
1. слабокислой
2. слабощелочной
3. сильнокислой
4. сильнощелочной
217. Ттитрование, при котором происходит реакция между определяемым веществом и раствором титранта называется:
1. прямое
2. обратное
3. косвенное
4. обратное с разведением
218. Объем титранта измеряют:
1. бюреткой
2. пальчиком
3. пипеткой
4. мерной колбой
219. Навеску исходного вещества взвешивают на весах:
1. на аналитических
2. на аптечных
3. на тарированных
220. Какой способ титрования выражает формула:

1. косвесное
2. обратное
3. прямое
4. прямое с разведением
221. Аммиачный буфер имеет состав:

1. а
2. б
3. в
4. г
222. Точку эквивалентности фиксируют:
1. по изменению окраски индикатора
2. по выпадению осадка
3. по изменению окраски титранта
4. все верно
223. Лакмус по своей природе - это:
1. щелочь
2. сильная органическая кислота
3. слабая органическая кислота
4. спирт
224. В комплексометрии титрант готовят:
1. по точной навеске
2. по приблизительной и точной навеске
3. по приблизительной навеске
225. Кальция хлорид можно определить методом:
1. иодометрии
2. перманганатометрии
3. трилонометрии
4. алкалиметрии
226. Методом комплексометрии можно определить:

1. а
2. б
3. в
4. г
227. Точку эквивалентности в комплексометрии фиксируют по индикатору:
1. кислотный хром черный и кислотный хром темно-синий
2. лакмус
3. флюоресцеин
4. тропеолин 00
228. Трилон Б имеет формулу:

1. а
2. б
3. в
4. г
229. При титровании в комплексометрии используют индикатор:
1. адсорбционный
2. кислотно-основной
3. металлоиндикатор
4. редокс индикатор
230. Выбрать индикатор для CH3COOK:
1. фенолфталеин
2. лакмус
3. метиловый оранжевый
4. метиловый краcный
231. Массовую долю растворенного вещества можно рассчитать использую формулу:
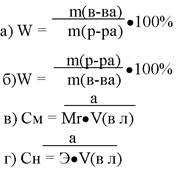
1. а
2. б
3. в
4. г
232. Для приготовления 500 мл 0,5н раствора NaCl необходимо взять навески:
1. 1,5 г
2. 40 г
3. 14,625 г
4. 55 г
233. Концентрация показывающая сколько грамм вещества содержится в одном миллилитре раствора, называется:
1. титр
2. нормальность
3. молярность
4. массовая доля
234. Выберите формулу для обратного титрования с разведением:

1. а
2. б
3. в
4. г
235. Вещество, которое титруют - это:
1. навеска
2. титрант
3. индикатор
4. все верно
236. Для определения точной концентрации рабочего раствора используют:
1. титрант
2. индикатор
3. установочное вещество
4. навеску
237. К мерной посуде не относится:
1. бюретка
2. цилиндр
3. пипетка
4. мерная колба
238. Кислотно-основное титрование основано на:
1. реакции разложения
2. реакции комплексообразования
3. реакции осаждения
4. реакции нейтрализации
239. Основное уравнение кислотно-основного титрования:

1. а
2. б
3. в
4. г
240. Алкалиметрия - это:
1. количественное определение кислот
2. количественное определение оснований
3. количественное определение солей
4. качественное определение солей
241. Титранты для ацидиметрии готовят приблизительной концентрации, потому что:
1. щелочи гигроскопичны и поглощают углекислый газ
2. кислоты образуют со временем осадки
3. хлороводородная кислота гигроскопична, а серная летуча
4. хлороводородная кислота летуча, а серная гигроскопична
242. В качестве установочного вещества в ацидиметрии используют:

1. а
2. б
3. в
4. г
243. Растворы установочных веществ в методе кислотно-основного титрования готовят по:
1. точной навеске
2. приблизительной навеске
3. точной или приблизительной навеске в зависимости от определяемого вещества
4. на глаз
244. Ионная теория индикаторов основана на:
1. теории электролитической диссоциации
2. теории окисления и восстановления
3. методе осаждения
4. методе комплексообразования
245. В кислой среде лакмус окрашивается в:
1. красный цвет
2. синий цвет
3. фиолетовый цвет
4. зеленый цвет
246. Показателем титрования называется та концентрация ионов водорода, при которой индикатор:
1. постепенно меняет свою окраску
2. полностью выпадает в осадок
3. не меняет свою окраску
4. резко меняет свою окраску
247. Метод комплексометрии основана на:
1. образовании прочного внутрикомплексного соединения, хорошо растворимого в воде, титранта с 2,3 и 4 зарядными ионами
2. реакции нейтрализации
3. реакциях осаждения, в результате которых образуется труднорастворимые соединения с небольшим произведением растворимости
4. окислительно-восстановительных реакциях между титрантом и навеской
248. Трилон Б - это:
1. соль полиаминокарбоновой кислоты
2. соль янтарной кислоты
3. соль щавелевой кислоты
4. соль, производное изопентана
249. Для фиксирования точки эквивалентности в методе комплексообразования можно использовать:
1. эозинат натрия
2. трилон Б
3. кислотный хром темно-синий
4. фенолфталеин
250. В методе ацидиметрии в качестве титрантов используют растворы веществ:

1. а
2. б
3. в
4. г
251. В каком из перечисленных титрований точка эквивалентности равна рН=7
1. а
2. б
3. в
4. г
252. В трилонометрии прочность комплекса обусловлена:
1. валентной связью
2. металлической связью
3. донорно-акцепторной связью
4. водородной связью
253. Чтобы сместить равновесие реакции в комплексометрии нужно добавить:
1. кислоту
2. щелочь
3. трилон Б
4. буферную смесь
254. Объем титруемого раствора отмеривают:
1. цилиндром
2. пипеткой
3. пальчиком
4. бюреткой
255. Величина "Х" выражает:
1. поправочный коэффициент
2. концентрация
3. вес одного порошка или одной таблетки
4. содержание вещества в порошке и концентрация вещества в растворе
256. К адсорбционным индикаторам относится:
1. фенолфталеин
2. метиловый оранжевый
3. эозинат натрия
4. хромат калия
257. К кислотно-основным индикаторам относятся все, кроме:
1. фенолфталеина
2. метилового оранжевого
3. метилового красного
4. хромогена
258. Методом нейтрализации можно определить содержание всех лекарственных средств, кроме:
1. кислоты хлороводородной
2. натрия гидрокарбоната
3. натрия салицилата
4. натрия бромида






