Теплоемкость – свойство тела (вещества). Теплоемкость – производная от количества теплоты по температуре в каком-либо термодинамическом процессе.
C=dQ/dT- истинная [C]=Дж/К (34)
В зависимости от количественной единицы вещества, к которому подводится теплота, различают теплоемкости:
- массовая – отношение теплоемкости вещества к его массе [с]=Дж/кг·К.
- объемная – отношение теплоемкости тела к его объему при нормальных физических условиях (р=101375 Па и Т=273К) [с’]=Дж/м3·К
- мольная - величина равная произведению массовой теплоемкости на молярную массу данного вещества [μс]=Дж/кмоль·К,
- μ-молярная масса, кг/кмоль.
Связь между названными теплоемкостями можно представить в следующей форме:
Например: с’= сρ [с’]= 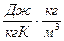 =
=  (35)
(35)
Самостоятельно: связь между μс и с’.
Зависимость теплоемкости от характера процесса.
Массовую теплоемкость можно представить исходя из 1-го закона термодинамики:
 ; (36)
; (36) 
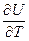 не зависит от характера процесса,
не зависит от характера процесса, 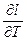 представляет собой удельную работу и зависит от характера процесса. Следовательно, теплоемкость также зависит от характера процесса.
представляет собой удельную работу и зависит от характера процесса. Следовательно, теплоемкость также зависит от характера процесса.
. Рассмотрим 2 случая нагрева идеального газа:
- в процессе постоянного объема V = const
- в процессе постоянного давления Р = const
Обозначим теплоемкости этих процессов соответственно 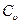 и Ср.
и Ср.
Для υ=const:
уравнение примет вид:  , т.к.
, т.к. 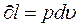 , а
, а  .
.
А т.к. внутренняя энергия идеального газа зависит только от температуры и не зависит от хода процесса, то можно записать
cυ=dU/dT→dU=cυdT. (37)
 (38)
(38)
для всех процессов вычисляется через температуру и изохорную теплоемкость
Для р=const
По 1-му закону термодинамики с учетом dl=pdυ=RdT
 (39)
(39)
Подставим в это выражение 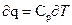 и
и  получим:
получим:
 ; (40)
; (40)
Разделив все члены ур-ия (40) на  выведем
выведем
– уравнение Майера 
 или R=Ср-Сυ(41)
или R=Ср-Сυ(41)
μср= μсυ+μR и μср= μсυ+  = 8314
= 8314 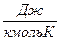 (42)
(42)
Разность теплоемкостей идеальных газов есть величина постоянная.
Истинная и средняя теплоемкости.
Теплоемкость идеального газа зависит от температуры, а реального и от Р(но эта зависимость слаба и ею обычно пренебрегают). Поэтому в технической термодинамике различают истинную и среднюю теплоемкости.
Производная от количества теплоты, подводимого к телу, по его температуре является истинной теплоемкостью: с =  (43)
(43)
Для процесса с произвольным изменением температуры
q =  (44)
(44)
если принять для простоты с=const, получим
q =c(T2 – T1) (45)
Для более точных расчетов при определении количества теплоты в нее подставляют среднее значение теплоемкости для диапазона температур от t1 до t2.
Средней теплоемкостью данного процесса в пределах температур от t1 до t2 называют отношение количества теплоты q1-2, переданного в процессе, к конечной разности температур t1- t2:
 (46)|
(46)|
Теплоемкость находят по таблицам или номограммам.
Теплоемкость смеси газов вычисляют по правилу аддитивности  (47)
(47)
с1,с2 и т.д. – средняя удельная теплоемкость компонентов смеси, кДж/кг·К;
x1,x2 и т.д. – массовая доля компонента смеси; ∑xi=1.
Отношение теплоемкостей газа при постоянных Р и V называется коэффициентом адиабаты.
 (48)
(48)
Энтальпия.
Известно, что h=U+pυ (47) или в дифф. форме dh=d(U+pυ)
т.к. pυ = RT, то перепишем dh=d(U+ RT)
или dh=dU+ RdT=
dh= cυdT+RdT=(cυ+R)dT= cрdT (49)
Если за начало отсчета принять 00C, то значение энтальпии данного состояния можно определить из формулы:
0→t 
Изменение энтальпии газа в конечном процессе: t1→t2 h2-h1=cp(t2-t1) (50)
Энтропия
. dq=dU+dl; dS=dq/T - функция состояния,
Т - абсолютная температура (К).
Из 1-го закона термодинамики:
dq=cυdT+ pdυ;
dS=dq/T=cυdT/T+ pdυ/T. (51)
Как следует из ур-ия (51) изменение энтропии зависит от хода процесса, т.к. – pdυ - работа зависит от хода процесса.
Сделаем подстановку: pυ=RT p=RT/υ,
Тогда ур-ие (51) примет вид:
dS = cυdT/T + RTdυ/Tυ = cυdT/T + Rdυ/υ; (52)
 (53)
(53)
ΔS =cυln(T2/T1) + Rln(υ2/υ1), при p=const; (54)
Выразим изменение энтропии через другие параметры. Продифференцируем уравнение состояния
pdυ + υdp =RdT
Разделим все члены уравнения на pυ, в результате получим:
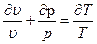 (55)
(55)
Путем подстановки в ур-ие (53) значений 
 и
и 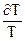 (из 55) получим следующие выражения:
(из 55) получим следующие выражения:
ΔS = cpln(T2/T1) + Rln(p1/p2), υ=const; (56)
ΔS = cυln(p2/p1) + cpln(υ2/υ1), T=const. (57)






