СОДЕРЖАНИЕ
Ведение…………………………………………………………………………..3-4
Цели работы……………………………………………………………………….5
1.1. Ароматическое нуклеофильное замещение: SNAr- реакции…………….6-7
1.2 Синтез арилазидов из арилгалогенидов и арилборных кислот, идущие под действием солей меди в качестве катализатора………………………………8-9
1.3 Диазониевые соли в синтезе арилазидов……………………………….10-11
1.4 Неводное диазотирование……………………………………………….12-15
1.5 Синтез арилазидов с участием гидразина………………………………16-19
1.6 Образование арилпентазенов и арилпентазолов……………………….20-21
1.7 Получение арилазидов под действием ультразвука…………………...22-23
Литература……………………………………………………………………….24
ВВЕДЕНИЕ
Первый органический азид, фенилазид, был открыт Питером Гриссом в 1864 году. С тех пор интерес к этим энергонасыщенным молекулам только возрастает. Органические азиды широко используются в органическом синтезе как удобные интермедиаты и строительные блоки благодаря их высокой реакционной способности. Разработаны многочисленные методы синтеза азотсодержащих гетероциклов с их участием, они находят применение в химии пептидов, полимерной химии и медицинской отрасли, так как зачастую обладают повышенной биологической активностью. Также органические азиды нашли применение в качестве фотоаффиных агентов – меток.
Классические методы внедрения азидной группы в ароматическое ядро представлены на Схеме 1 и включают:
1) нуклеофильное ароматическое замещение (SNAr), протекающее при наличии активирующей электроноакцепторной группы в ароматическом кольце;
2) диазотирование органических аминов в кислой среде с последующей обработкой азидом натрия, либо реакция диазоперегруппировки ароматических аминов с трифлилазидом;
3) реакции арилгалогенидов и арилборных кислот, идущие под действием солей меди в качестве катализатора;
4) прямое С-Н азидирование анизола под действием ультразвука - реакция протекает в пара-положение к метокси-групее и представляет собой частный случай реакции Фриделя-Крафста.
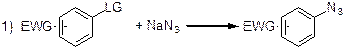

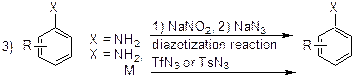

Однако, выше описанные методы синтеза не могут быть использованы в том случае, если арильное кольцо исходного субстрата несет функциональную группу, чувствительную к сильным кислотным или основным условиям проведения реакция. Поэтому в данной работе нами была предпринята попытка свести реакцию Зандмейера к более мягким условиям, открыв тем самым путь к получению ранее неизвестных арилазидов.
Цели работы:
Разработка метода неводного азидирования по реакции Зандмеера для азидирования субстратов, нестойких в кислой среде.
Актуальность работы:
Органические азиды - это класс азотсодержащих соединений, которые широко используются в органическом синтезе, поэтому разработка новых мягких методов синтеза весьма актуальна.
Новизна: разработанные нами условия неводного азидирования описываются впервые.
Практическая значимость: наш метод позволяет получать органические азиды, которые не могут быть получены в присутствии водных минеральных кислот.
Выводы
1. разработан метод неводного азидирования с использованием системы…
2. с использованием новой системы реагентов нами впервые получено о-азидоарилдифурилметаны из о-аминоарилдифурилметанов.
1.1. Ароматическое нуклеофильное замещение: SNAr- реакции
Одним из наиболее распространенных методов синтеза ароматических азидов является замещение азид-ионом различных электроноакцепторных групп, либо в орто-, либо в пара-положении по отношению к потенциальной уходящей группе. Так, фторзамещенные арилазиды – наиболее популярные фотоаффинные метки, используемые для изучения строения и свойств белков, были получены этим путем хорошими выходами. Перфторфенилазды 2d и 2f были использованы, в том числе, для мультишагового синтеза р -азидотетрафторфениланилина 3.

Схема 1
Замена уходящей группы (галогенидной, сульфонатной, нитро-) в активированных гетарильных соединениях азидной функцией открывает доступ к синтезу азидо-1,3,5-триазинов 5, азидопиридинов 7, азидохинолинов 9, азидо-1,3-4-оксадиазолов 11, 5-азидо-2-ацилфуранов 13 и 3-азидо-5-фенил-1,2,3-оксадиазолов 15.

Схема 2
Расщепление гетарильных сульфонов из полимерных основ может быть достигнуто в ходе реакции с азид-ионом. Саклинг и соавторы применил этот подход к синтезу птеридинов. Как видно из Схемы 4 в начале пиримидин связан с полистереном за счет тиоэфира 16. После образования кольцевой системы птеридина, происходит активация серного мостика за счет окисления диметилдиоксираном до сульфона, с последующим нуклеофильным замещением на азидную группу, что в конечном итоге приводит к образованию целевой молекулы 20 с выходом 41%.
 Схема 4
Схема 4
Синтез арилазидов из арилгалогенидов и арилборных кислот, идущие под действием солей меди в качестве катализатора
В реакциях нуклеофильного замещения йодидной группы в качестве промотирующего катализатора может быть использована гетероциклическая аминокислота L-пролин (см. схемы.
 Схема 5
Схема 5
Синтезирующиеся in situ арил- и гетарилазиды, из соответствующих арилгалогенидов, в присутствие L-пролина и солей меди реагируют с алкинами, образуя в ходе «one-pot»-реакции 1,4-дизамещенные 1,2,3-триазолы 23. Liang и соавторы получили аналогичным образом 1,4-дизамещенные 1,2,3-триазолы 24 из арилбромидов, либо арилйодидов и терминальных алкинов в присутствии азида натрия и соответствующих катализаторов. На схеме 6 показано также каким образом данный синтез может быть выполнен в смеси ионной жидкости [bmim][BF4] и воде.


Схема 6
Использование борных кислот позволяет получить арилазиды и 1-арил-1,2,3-триазолы в более мягких условиях, толерантных к большему числу субстратов. Действительно, и электронодонорная и электронодефицитная борные кислоты 25 могут быть эффективно превращены в соответствующие арилазиды 26 в присутствии азида натрия и CuSO4. Пример использования арилборпроизводных в синтезе 1,2,3-триазолов 27 представлен на схеме 7.


Схема 7






