Ход и данные опыта
Перед практическим выполнением опыта проведем теоретическую качественную оценку возможности протекания реакций в соответствии с условием самопроизвольного протекания окислительно-восстановительных реакций в водных растворах электролитов
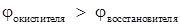
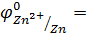 _______
_______ 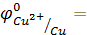 _______
_______
 ________
________  ______
______
Перед началом эксперимента запишем 9 уравнений окислительно-восстановительных реакций взаимодействия металлов Zn, Cu, Al с растворами солей ZnSO4, CuSO4, Al2(SO4)3, FeCl3 в молекулярной и краткой ионной формах. Укажите окислитель и восстановитель. Используя значения электродных потенциалов определите возможность протекания реакций.
Запишите уравнения реакций образования турнбулевой сини при взаимодействии Zn, Cu с раствором FeCl3 ___________________________________________________________
______________________________________________________
______________________________________________________________________________________
В ходе эксперимента проведем только те взаимодействия, которые были определены выше. Для этого в пробирки с небольшим количеством 0,5 н растворов солей опустим гранулы (кусочки) соответствующих металлов. Результаты проверки и наблюдаемые признаки реакций запишем в таблицу 1.
Таблица 1.
| CuSO4 | ZnSO4 | Al2(SO4)3 | FeCl3 (индикатор K3[Fe(CN)6]) | |
| Zn | ||||
| Cu | ||||
| Al |
Почему при взаимодействии Al с растворами солей признаков реакций не наблюдали? ______________________________________________________________
________________________________________________________
Анализа результатов опыта
1. Какой из исследованных металлов самый активный и какой наименее? Расположите исследуемые металлы по убыванию их активности в водных растворах. Ответ должен быть обоснованным. ______________________________________________________________
________________________________________________________
2. Согласуются ли полученные результаты с вашим прогнозом возможного протекания реакций и теоретическими положениями. ______________________________________________________
3.Сделайте вывод о химической активности металлов в водных растворах электролитов. Укажите влияние пассивирующих (оксидных) слоев на поверхности активных металлов на характер протекания окислительно-восстановительных реакций. ___________________________________________________________
________________________________________________________________________________________
2. Определение стандартной ЭДС химического гальванического элемента
Ход и данные опыта
Для выполнения данного опыта соберем медно-цинковый гальванический элемент. Для этого нальем в два химических стакана 1М растворы солей: в один – ZnSO4, в другой – CuSO4. Погрузим в них электроды: цинковый в ZnSO4, медный в CuSO4. Соединим электролиты электролитическим мостиком и, подсоединив электроды к измерительному прибору, измерим ЭДС.
εпракт = ___________
Анализа результатов опыта
1.Запишите схемы цинкового и (отдельно) медного электродов. Используя данные табл. П.2, выпишите значения стандартных электродных потенциалов и уравнения реакций, протекающих на данных электродах. Определите катод и анод. Составьте электрохимическую схему медно-цинкового гальванического элемента в молекулярной и ионной формах, уравнения анодно-катодных процессов и суммарное уравнение токообразующей реакции. Вычислите значение стандартной ЭДС. _________________
___________________________________________________________________________________
Объясните, почему экспериментальное значение ЭДС меньше рассчитанного_________________________________________
_________________________________________________
2. Рассчитайте изменение свободной энергии Гиббса (∆G0), максимально полезную работу (Ам) и константу равновесия (КР). ___________________________________________________________
____________________________________________
3. Не проводя эксперимента, рассчитайтезначения ЭДС исследуемого элемента при концентрациях растворов:
а) 0,001 М ZnSO4 и 1 М СuSO4; б)1 М ZnSO4 и 0,001 M СuSO4.
_________________________________________________________
Сравните полученные значения ЭДС с величиной стандартной ЭДС и сделайте вывод о влиянии концентраций потенциалопределяющих ионов на величины электродных потенциалов и значения ЭДС. _________________________________
____________________________________________
4. Как изменятсяпроцессы, если Zn- и Cu-электроды (оба) поместить в один и тот же раствор серной кислоты (H2SO4)? Как называется такой элемент? Ответ обосновать приведением электрохимической схемы элемента, уравнениями электродных реакций. Вычислите теоретическое значение ЭДС элемента. ___________________________________________________________
____________________________________________________________________________
5. Объясните, почему с течением времени в таком элементе значение ЭДС уменьшается? Какая поляризация имеет место в элементе Вольта, чем она обусловлена? Какими способами можно уменьшить поляризацию и увеличить численное значение ЭДС? ___________________________________________________________
___________________________________________________________________________________________________________
6. Сделайте обобщающий вывод, от каких факторов зависит численное значение ЭДС химических гальванических элементов. ___________________________________________________________
____________________________________________
Электролиз растворов солей на инертных электродах
В опыте исследуем процессы, протекающие на графитовых электродах при прохождении постоянного тока через растворы солей CuSO4, KI, NaCl. При выполнении работы используются: электролизер (U‑образная стеклянная трубка, закрепленная в штативе), графитовые электроды, выпрямитель тока Е‑24М или ИЭПП‑2 и 0,5 М растворы солей CuSO4, KI, NaCl.
3.1. Электролиз раствора сульфата меди CuSO4
Данные опыта
Перед выполнением эксперимента составим схему электролиза раствора CuSO4. на графитовых электродах. Запишем суммарное уравнение.
Нальем в электролизер 0,5М раствор CuSO4 так, чтобы электроды были погружены в электролит на глубину 2-3 см. Присоединим графитовые электроды к источнику постоянного тока: катод к минусу (–), анод к плюсу (–). Пропустим электрический ток (напряжение 15 – 20В) в течение 3–5 мин. и будем наблюдать за процессами на электродах. Затем опустите в анодное пространство полоску лакмусовой бумаги и определите РН раствора.
_______________________________________
Анализ результатов опыта
1. Опишите результаты наблюдений. Почему поверхность катода покрыта медью, как это связано с ее активностью? ___________________________________________________________
____________________________________________
2. Что наблюдаете на аноде? Увеличение концентрации каких ионов в результате реакции у анода обусловило изменение РН раствора? Какой газ выделился на аноде? Окисляются ли кислородсодержащие ионы SO42– на аноде при данном напряжении? ___________________________________________________________
__________________________________
2. Согласуются ли полученные результаты с теоретическими положениями? Подтвердите, сравнив значения электродных потенциалов. _______________________________________________
____________________________________________
3. Вывод (что установлено в результате выполнения опыта на аноде и на катоде)____________________________________________ ___________________________________________________________
______________________________________________________
___________________________________________________________
3.2. Электролиз раствора хлорида натрия NaCl
Данные опыта
Перед выполнением эксперимента составим схему электролиза раствора NaCl и запишем суммарное уравнение. Используя описанную методику проведем электролиз 0,5М раствора NaCl.
__________________________________
Анализ результатов опыта
1. Опишите результаты наблюдений на катоде. Увеличение концентрации каких ионов в результате реакции у катода обусловило изменение окраски фенолфталеина в малиновый цвет? Как изменится при этом значение рН электролита? Какой газ выделился на катоде? Почему на катоде не выделился металлический натрий? ____________________________________________________________
________________________________________
2. Объясните, почему раствор в анодном пространстве окрасился в синий цвет при добавлении раствора KI и крахмала?Какие ионы окислились на аноде? Запишите уравнение качественной реакции на молекулярный хлор. Почему на аноде не окислилась вода?_____________________________________________
__________________________________________________________________________________
3. Согласуются ли полученные результаты с теоретическими положениями? Подтвердите, сравнив значения электродных потенциалов. ________________________________________________
____________________________________________
4. Вывод (что установлено на аноде и на катоде в результате выполнения опыта) __________________________________________
______________________________________________________
___________________________________________________________
3.3. Электролиз раствора иодида калия KI
Данные опыта
Перед выполнением эксперимента составим схему электролиза раствора KI и запишем суммарное уравнение. Используя описанную методику проведем электролиз 0,5М раствора KI.

__________________________________
Анализ результатов опыта
1. Опишите результаты наблюдений. Почему на катоде не выделился металлический калий? Какой газ выделился на катоде? Увеличение концентрации каких ионов в результате реакции у катода обусловило изменение окраски фенолфталеина в малиновый цвет? Как изменится при этом значение рН электролита? Почему раствор в анодном пространстве окрасился в синий цвет при добавлении крахмала? Какие ионы окислились на аноде? _________________________________________________________
_________________________________________________________________________
2. Согласуются ли полученные результаты с теоретическими положениями?________________________________________________ ___________________________________________________________
3. Сделайте обобщающий вывод об особенностях процессов электролиза на инертных электродах, указав для каждого из трех опытов основные факторы, определяющие природу продуктов электролиза.________________________________________________
____________________________________________
Ответы на контрольные вопросы
1.Составьте схему гальванического элемента, в котором самопроизвольно протекает реакция
Cd + FeSO4 = CdSO4 + Fe.
Определите концентрацию раствора CdSO4, если железный электрод – стандартный, а ЭДС элемента равна 80 мВ.Запишите и рассчитайте значение константы равновесия. _______________________________
___________________________________________________________________________________
2. Укажите, при каких условиях можно создать гальванический элемент из двух электродов 1-рода одинаковой химической природы. Приведите пример такого элемента, уравнения анодно-катодных процессов и рассчитайте ЭДС, ∆ G и Ам.
__________________________________
3. Составьте схему электролиза 1М раствора NiCl2 (рН= 5) на стальном катоде и графитовом аноде. Запишите уравнения анодно-катодных процессов и суммарное уравнение электролиза. Рассчитайте, насколько увеличилась масса катода, если на аноде выделилось 112 л газа. Какой силы ток проходил через систему в течение 10ч., если выход по току составил 100%. ________________
___________________________________________________________
______________________________________________________________________________
4. Приведите схему электролизной системы для получения металлического кальция. Запишите уравнения электродных реакций и рассчитайте количество электричества, необходимое для получения 1 моля кальция. ___________________________________ ____________________________________________________________________






