Химические реакции - через элементарные стадии, поэтому n определяют экспериментально.
Эксперимент: измеряют С реагир.веществ = f (t)
Обрабатывают полученные данные кинетических исследований на основании решения кинетического уравнения: – d C /d t = kCn:
1) подставляют в константу скорости реакций 1, 2 и т.д. порядков.
Критерий - постоянство k.
2) строят графики:
В зависимости от порядка реакции линейными являются графики в различных координатах
Таблица
| Порядок реакции | Кинетическое уравнение | Координаты, в которых график зависимости С (t)линеен |
| – d C /d t = k | С - t | |
| – d C /d t = kC | ln С - t | |
| – d C /d t = kC2 | 1/ C - t | |
| n | – d C /d t = kCn | 1/ Cn-1 - t |
Константу скорости можно определить как аналитически (см. выше), так и графически – по величине наклона этих прямых на графиках в соответствующих координатах.

Правило Вант-Гоффа
|
γ = (2-5) - температурный коэффициент

(для приблизительных расчётов).
 gэкзотерм.< gэндотерм. v
gэкзотерм.< gэндотерм. v
DrН>0
DrН<0
Т
К реакции приводит столкновение лишь тех молекул, энергия которых больше определённой величины E a.

По распределению Максвелла-Больцмана:
число активных молекул Na: 
если Т = 300К, Еа = 100483 Дж/моль
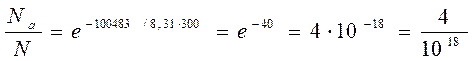
На 1018 молекул - только 4 молекулы активные
Еа определяется природой реагирующих молекул

 Е а не является f (T) – с Т Þ доля активных молекул
Е а не является f (T) – с Т Þ доля активных молекул

Источник активации: тепловая или электрическая энергия, hv, радиоактивность, рентген.
 |
k 0 – предэкспоненциальный множитель, не зависит от Т физич. смысл: k 0 = k , если Е а = 0
Кроме Е а для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения - стерический фактор.
 |
Неблагоприятная ориентация благоприятная ориентация
Вероятность надлежащей ориентации при столкновении характеризуется энтропией активации
Sакт = RlnW Þ W = eSa/R Þ k0 = Z×W Þ
Þ ko = Z× eSa/R
Z- общее число соударений в единице объема за единицу времени.
k = ko ×eEa/RT = Z× eSa/R ×eEa/RT
u = kCa A×CbB = Z× eSa/R ×eEa/RT × Ca A× CbB

▒ строят график зависимости в координатах (lg k, 1/T).

или 
 |
lg k
lg k0 tg a= 
a
1/T
Уравнение Аррениуса в дифференциальной форме:


 т.к. Ea /(RT2) > 0 Þ с температуры Þ k
т.к. Ea /(RT2) > 0 Þ с температуры Þ k
k реакции с большей Еа возрастает с температурой сильнее.
Зная k при T1 и T2 Þ рассчитывают Еа.
Интегрируем от T1 до T2 Þ

Связь энергии активации с DrH
Пусть протекает равновесная реакция:
АВ + ДС ÛАД + ВС
● для прямой реакции:

● для обратной реакции:

Вычитая из первого уравнения второе, получим:

 - выражение закона действия масс
- выражение закона действия масс
К – константа равновесия

 - изобара Вант-Гоффа
- изобара Вант-Гоффа
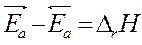 Þ связь термодинамических и кинетических параметров
Þ связь термодинамических и кинетических параметров

 |






