В качестве катализаторов в этом виде катализа используются кислоты или основания. В зависимости от относительной кислотности или основности реагентов и свойств среды кислотно-основное взаимодействие кислоты и реагента может приводить к образованию ассоциатов за счет водородных связей, комплексов с переносом заряда (ионных пар) или свободных ионов. Эти взаимодействия активируют молекулы реагентов и, в конечном счете, обусловливает каталитический эффект.
В общем случае в качестве каталитических частиц в кислотном катализе выступают ионы, молекулы растворителя, имеющие кислотную функцию, и недиссоциированные молекулы кислоты – катализатора.
Каталитические реакции протекают по циклическому маршруту, т. е. по маршруту, состоящему из нескольких последовательных или последовательно-параллельных стадий, в результате которых один из компонентов — катализатор, расходуемый в первой стадии, вновь регенерируется в последней стадии. Остальные компоненты исходной реакционной смеси — субстраты каталитической реакции — в результате этого циклического маршрута превращаются в продукты реакции.
Механизмы:
Промежуточное химическое взаимодействие реагентов с катализатором может протекать по двум видам механизма – слитно и раздельно.
1)При слитном механизме с состав активированного комплекса (промежуточного соединения) входят, наряду с катализатором, все реагирующие вещества и реакция идёт по схеме:
1. A + B ® AB  ® D + E без катализатора,
® D + E без катализатора,
2. A + B +K® ABK  ® D + E + K c катализатором.
® D + E + K c катализатором.
Увеличение скорости реакции в этом случае объясняется уменьшением энергии активации процесса.
Такой механизм катализа часто встречается в окислительно-восстановительных реакциях, и роль катализатора в этом случае сводится к созданию нового, более эффективного пути переноса электрона от восстановителя к окислителю.
2)При раздельном механизме каталитический процесс осуществляется поэтапно:
3. 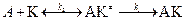 .
.
4. 
Как правило, катализатор снижает энергию активации реакции и ускоряет её. Замедлить реакцию (не цепную) катализатор не может, так как если в присутствии катализатора энергия активации растёт, то реакция пойдёт по обычному, не каталитическому пути и скорость её окажется прежней. Замедляющее действие катализатор может оказывать на цепную реакцию, когда он ускоряет стадию обрыва цепи.
Так протекает катализ химических превращений ионами металлов и их координационными соединениями и катализ ферментами.
Кинетика:
???????????






