1. Решение ситуационных задач (примеры приведены ниже):
1.1. В медицине применяют 10% раствор хлорида кальция. Возможно ли использование 0,2 н раствора хлористого кальция (ρ = 1,0316 г/мл) для внутривенного введения?
1.2. Бензофурокаин представляет собой местный анестетик с компонентом центрального анальгезирующее действия. Максимальная суточная доза составляет 1 г препарата. Для обезболивания назначено капельно по 30 мл 1%-ного раствора 3 раза в сутки. Не превышена ли в назначении максимальная суточная доза?
1.3. В 280 г воды растворили 40 г глюкозы. Найти массовую долю и молярную концентрацию полученного раствора (ρ=1400 кг/м3).
2. Выполнение лабораторной работы
Лабораторная работа № 1. Приготовление раствора заданной концентрации
Вопросы для подготовки по теме (ответы пишутся до лабораторной работы):
1. Какой объем воды необходим для приготовления 20 г 5 % раствора гидроксида натрия?
____________________________________
2. Рассчитайте молярную (См) и нормальную (Сн) концентрацию раствора фосфорной кислоты с массовой долей 14,6 % (плотность раствора (ρ) равна 1,08г/мл).
________________________________________________________________________
3. Значение титриметрического анализа в медико-биологических исследованиях?
____________________________________
4. Каким образом можно точно измерить объем раствора?
_________________________
5. Что такое точка эквивалентности?
__________________________________________________
6. Что такое титрант и титруемое вещество?
____________________________________
7. Какие вещества называются индикаторами?
__________________________________________________
8. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
__________________________________________________
Реактивы и оборудование: 1 М раствор СН3СООН; 0,1 М раствор NaOH; дистиллированная вода; раствор фенолфталеина; бюретка; воронка; пипетка на 5; пипетка на 10 мл; груша; мерная колба на 50; 2 стакана; 3 колбы для титрования; цилиндр.
Отчет о работе
Опыт 1. Приготовление 0,1 М раствора уксусной кислоты.
Рассчитали объем 1М раствора уксусной кислоты, необходимый для приготовления 50 мл раствора заданной концентрации
___________________________________________________________________________
_________________________
Взяли пипеткой объёмом 5 мл рассчитанный объем 1М раствора кислоты, перенесли его в мерную колбу и довели объем до метки дистиллированной водой. Раствор перемешали и вылили в стакан.
Пипеткой из стакана отобрали 10 мл приготовленного раствора и перенесли его в колбу для титрования. Добавили 2-3 капли фенолфталеина. Таким образом заполнили три колбы для титрования.
Бюретку заполнили 0,1 М раствором гидроксида натрия.
Заполненность бюретки и пипетки определяли по нижнему мениску.
Взяли колбу с приготовленным раствором кислоты и индикатора и по каплям добавляли щелочь из бюретки, до появления розовой окраски раствора.
Оттитровали растворы кислоты (раствор считается оттитрованным, если при добавлении 1 капли щелочи окраска раствора не исчезает в течение 1 минуты).
Данные титрования занесли в таблицу
| Объем кислоты, взятый для титрования, мл | Объем щелочи, пошедший на титрование, мл | Концентрация кислоты, моль/л | Концентрация щелочи, моль/л |
| 0,1 | |||
| 0,1 | |||
| 0,1 |
По закону эквивалентов рассчитали концентрацию полученной кислоты и результаты записали в таблицу (для расчета использовали средний общий объем щелочи, пошедшей на титрование
Vcp = (V1 + V2 + V3)/ 3).
.
Рассчитали ошибку эксперимента по формуле
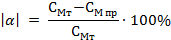
Вывод: ___________________________________________________________________________
Отчет принял преподаватель: ______________________ (подпись, дата, количество баллов за выполненную работу)






