Типичные восстановители
1. Металлы I, II, III групп периодической системы. (Na, Ca, Al …)
2. Катионы металлов в низшей степени окисления ( ).
).
3. Ионы неметаллов в низшей степени окисления ( ).
).
4. Технические восстановители ( ).
).
5. Гидриды металлов ( ).
).
Типичные окислители.
1. Галогены ( ).
).
2. Кислород  .
.
3. Катионы металлов высшей степени окисления ( ).
).
4.  и
и 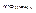 .
.
Неметаллы промежуточной степени окисления обладают окислительно-восстановительной двойственностью:


Азотная кислота
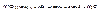
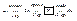 – электрохимический ряд напряжений.
– электрохимический ряд напряжений.
 |
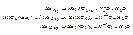

Серная кислота


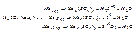

№2
Реакции окисления-восстановления. Метод электронного баланса.
Окислительно-восстановительные реакции:
1. Реакции межмолекулярного окисления-восстановления
 ;
;
2. Реакции диспропорционирования:
 ;
;
3. Реакции внутримолекулярного окисления-восстановления:
 .
.
Существует 2 метода составления окислительно-восстановительных реакций:
1) метод электронного баланса,
2) метод полуреакций.
В методе электронного баланса сравниваются степени окисления атомов в исходных и конечных веществах, а в методе полуреакций – составляются ионные уравнения.
Метод электронного баланса.



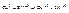
Правила расстановки коэффициентов.
 .
.
1. Составить схему ОВР, включив в неё только те атомы, которые изменили степень окисления:

2. Записать реакцию в виде двух полуреакций, отвечающих процессам окисления и восстановления:


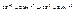
3. Поместить полученные коэффициенты в молекулярное уравнение:
4. Проверить, расходуется ли окислитель и восстановитель на другие процессы.
№3.
Молярные массы эквивалентов окислителей и восстановителей. Направление протекания ОВР.
Вероятность протекания ОВР определяется изменением энергии Гиббса. Если  , то реакция возможна при данных условиях.
, то реакция возможна при данных условиях.
 ,
,
где Z – наименьшее общее кратное между числом отданных и принятых электронов,
E  – ЭДС или напряжение ОВР,
– ЭДС или напряжение ОВР,
F – число Фарадея  .
.

где K – константа ОВР (характеризует глубину протекания процесса).
 |
 ,
,
 .
.
Окислитель и восстановитель взаимодействуют в эквивалентных количествах:

Закон эквивалентов ОВР.



 ,
,  ,
,
где  – число отданных/принятых
– число отданных/принятых  одной формульной единицей.
одной формульной единицей.
№4
Электродный потенциал. Его измерения. Стандартный электродный потенциал.
При погружении металла в воду происходит его растворение до установления равновесия.

 Под взаимодействие полярных молекул воды происходит с одной стороны разъединение ионов и электронов, а с другой стороны взаимное притяжение.
Под взаимодействие полярных молекул воды происходит с одной стороны разъединение ионов и электронов, а с другой стороны взаимное притяжение.

 Если металл активный, то в узлах кристаллической решётки ионы, притягиваясь отрицательным полюсом молекул воды, переходят в раствор. Если же металл неактивный, то ионы металла теряют свою гидратную оболочку и переходят из раствора в кристаллическую решётку, заряжая тем самым металл положительным зарядом. На границе “металл-раствор”, образуется двойной электронный слой, который характеризуется разностью потенциалов и называется электродным потенциалом. Обозначается –
Если металл активный, то в узлах кристаллической решётки ионы, притягиваясь отрицательным полюсом молекул воды, переходят в раствор. Если же металл неактивный, то ионы металла теряют свою гидратную оболочку и переходят из раствора в кристаллическую решётку, заряжая тем самым металл положительным зарядом. На границе “металл-раствор”, образуется двойной электронный слой, который характеризуется разностью потенциалов и называется электродным потенциалом. Обозначается –  .
.
Электродом сравнения является водородный электрод, потенциал которого принят за ноль.
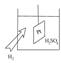 Водородный электрод состоит из платиновой пластины, погружённой в раствор
Водородный электрод состоит из платиновой пластины, погружённой в раствор  . В сосуд вдувается чистый водород.
. В сосуд вдувается чистый водород.
 ,
,
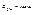 ,
,
 ,
, 






