АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ.
ГАЗОВЫЕ ЗАКОНЫ
Атом, молекула, химический элемент. Современная система атомных и молекулярных масс. Моль. Молярная масса.
Нормальные условия для газов. Закон Авогадро. Число Авогадро. Молярный объем газа. Абсолютная и относительная плотность газов. Объединенный газовый закон. Уравнение Менделеева–Клапейрона. Универсальная газовая постоянная. Парциальное давление газа. Закон Дальтона.
Вопросы и задачи: 3, с.13, № 1, 3, 6, 10, 12, 13, 17, 19, 22, 24, 27, 29.
Литература: 3, с. 9–12; 6, с. 25–39; 5, с.21.
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Гомо- и гетеросоединения. Простые и сложные вещества.
Степень окисления. Определение степени окисления элементов в зависимости от их положения в периодической системе. Составление формул соединений, исходя из степени окисления элемента.
Оксиды. Номенклатура и классификация оксидов. Графические формулы оксидов. Получение и химические свойства. Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Основания. Номенклатура и классификация оснований. Свойства нерастворимых в воде оснований. Свойства щелочей. Свойства гидроксида аммония. Амфотерные гидроксиды и их свойства. Получение оснований. Характер изменения свойств оснований в зависимости от положения металла в периодической системе и его степени окисления. Графические формулы оснований.
Кислоты. Номенклатура и классификация кислот. Химические свойства кислот. Способы получения кислот. Зависимость силы кислоты от положения элемента в периодической системе и его степени окисления. Графические формулы кислот и кислотных остатков.
Соли. Номенклатура и классификация солей. Способы получения и свойства средних солей. Способы получения и свойства кислых солей. Способы получения и свойства основных солей. Графические формулы средних, кислых и основных солей.
Вопросы и задачи: 3, с. 36, № 3, 4, 7–9, 11, 12, 17–19, 21, 25–28, 33, 40.
Литература: 3, с. 16–35; 7, с. 4–48.
ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
Эквивалент, фактор эквивалентности. Эквивалент элемента в соединениях. Расчет молярных масс эквивалентов сложных веществ (кислот, оснований, солей) в реакциях. Закон эквивалентов.
Вопросы и задачи: 3, с. 43, № 1–3, 5, 10, 13, 15, 18, 20, 21, 25, 28.
Литература: 3, с. 40–43; 4, с. 31–37; 5, с. 15–21.
ТЕРМОХИМИЯ
Закон сохранения массы-энергии. Теплота, работа, внутренняя энергия, единицы их измерения.
Тепловой эффект реакции. Энтальпия. Экзо- и эндотермические реакции. Термохимические уравнения. Закон Гесса и следствия, вытекающие из него. Зависимость энтальпии от массы вещества (пробега реакций) и температуры.
Простое вещество. Стандартное состояние. Стандартная энтальпия образования соединений из простых веществ. Стандартная энтальпия образования ионов, относительный характер значений энтальпии образования ионов.
Примеры применения закона Гесса для вычисления изменения энтальпии в различных процессах (образования, растворения, сгорания веществ и др.).
Вопросы и задачи: 3, с. 70, № 3, 5, 8, 10, 15, 17, 24, 25, 27, 34.
Литература: 1, с. 175–189; 2, с. 172–185; 3, с. 47–61; 5, с. 42–61.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Обратимые и необратимые реакции. Химическое равновесие, характеристика состояния химического равновесия. Константа химического равновесия. Закон действующих масс (запись константы химического равновесия для различных гомогенных и гетерогенных процессов).
Вычисление равновесных концентраций (или парциальных давлений) при известных начальных концентрациях исходных веществ и заданной степени превращения. Расчет равновесных концентраций (или парциальных давлений) по известным начальным концентрациям исходных веществ и константе равновесия.
Вопросы и задачи: 3, с. 90, № 1–3, 5–7, 11, 15, 19, 20, 30.
Литература: 1, с. 197–200; 2, с. 185–187; 3, с. 76–90; 5, с. 62–67, 80–86.
ЭНТРОПИЯ
Энтропия как мера неупорядоченности состояния. Стандартные энтропии веществ S 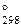 . Расчет изменения энтропии D S
. Расчет изменения энтропии D S 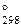 в различных процессах.
в различных процессах.
Вопросы и задачи: 3, с. 103, № 1, 3.
Литература: 1, с. 189–192; 2, с. 187–194; 3, с. 96–102; 5, с.68–70.
ИЗМЕНЕНИЕ ЭНЕРГИИ ГИББСА
Изменение энергии Гиббса (D G ˚) как термодинамический критерий направленности процесса. Уравнение изотермы реакции и стандартное изменение энергии Гиббса. Связь D G 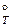 с константой равновесия.
с константой равновесия.
Стандартная энергия Гиббса образования соединения из простых веществ D G 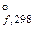 . Связь изменения стандартной энергии Гиббса со стандартными изменениями D H
. Связь изменения стандартной энергии Гиббса со стандартными изменениями D H 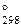 и D S
и D S 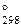 процесса и зависимость D G
процесса и зависимость D G 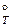 от температуры. Расчет D H
от температуры. Расчет D H 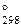 , D S
, D S 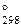 , D G
, D G 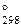 и D G
и D G 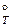 с использованием таблиц стандартных термодинамических величин.
с использованием таблиц стандартных термодинамических величин.
Вычисление констант равновесия для различных температур.
Изменение стандартной энергии Гиббса как количественная мера глубины и направления химической реакции. Термодинамический анализ различных процессов (обратимых и необратимых).
Вопросы и задачи: 3, с. 121, № 2–5, 7, 12, 16, 17, 18, 24, 27, 32.
Литература: 1, с. 192–200; 2, с. 194–203; 3, с. 104–121; 5, с. 71–73.
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ.
ПРИНЦИП ЛЕ ШАТЕЛЬЕ
Смещение химического равновесия. Влияние изменения концентраций, парциальных давлений, температуры на состояние химического равновесия. Влияние изменения общего давления. Принцип Ле Шателье.
Вопросы и задачи: 3, с. 130, № 4, 11, 12.
Литература: 1, с. 200–201; 2, с. 212–216; 3, с. 127–130; 5, с. 86–89.
РАСТВОРЫ
Общие свойства растворов. Раствор как многокомпонентная система. Процессы, сопровождающие образование растворов. Сольватация.
Растворимость. Влияние на растворимость природы растворенных веществ и растворителя, температуры и давления. Насыщенные, ненасыщенные и пересыщенные растворы.
Различные способы выражения концентрации растворов:
а) Массовая доля растворенного вещества. Расчеты, связанные с использованием плотности растворов.
Вопросы и задачи: 3, с. 143, № 1, 5, 7, 19, 20, 21, 30, 32–34, 36, 49, 51, 54, 59.
б) Молярная концентрация раствора. Молярная концентрация эквивалента. Взаимные пересчеты способов выражения состава растворов.
Вопросы и задачи: 3, с. 143, № 4, 6, 8, 9, 11, 12, 14, 15, 17, 22, 23, 26, 27, 37, 41, 55, 57. Литература: 3, с. 133–143; 6, с. 49–52, 55–56, 59–63, 8, с. 4-19.






