Средние соли – продукты полного замещения атомов водорода в молекуле кислоты атомами металла, или продукты полного замещения гидроксогрупп в молекуле основания кислотными остатками:
2NaOH + H2SO4 = Na2SO4 + 2H2O
сульфат натрия или
тетраоксосульфат (VI) натрия
 С точки зрения теории электролитической диссоциации средние соли это электролиты, которые диссоциируют в водных растворах или расплавах на катионы металла (или катион аммония) и анионы кислотного остатка:
С точки зрения теории электролитической диссоциации средние соли это электролиты, которые диссоциируют в водных растворах или расплавах на катионы металла (или катион аммония) и анионы кислотного остатка:
Na2SO4 = 2Na+ + SO42-
Ca3(PO4)2 = 3Ca2+ + 2PO43-
Названия солей тесно связаны с номенклатурой соответствующих кислот. Для солей распространенных кислот сохраняются традиционные названия: Na2SO4 – сульфат натрия (тетраоксосульфат (VI) натрия), KNO3 – нитрат калия (триоксонитрат (V) калия), K3PO4 – ортофосфат калия (тетраоксофосфат (V) калия), K2CO3 – карбонат калия (триоксокарбонат (IV) калия), KMnO4 – пермaнганат калия (тетраоксоманганат (VII) калия), Li2CrO4 – хромат лития (тетраоксохромат (VI) лития).
Для солей кислородсодержащих кислот хлора, йода и некоторых других элементов, проявляющих несколько степеней окисления, а также для солей полимерных и других сложных кислот, в правилах ИЮПАК рекомендуется применять систематические названия (традиционные русские названия – в скобках): KClO – оксохлорат калия (гипохлорит калия) KClО3 – триоксохлорат калия (хлорат калия), KСlO4 тетраоксохлорат калия (перхлорат калия), Na6TeO6 – гексаоксотеллурат гексанатрия (ортотеллурат натрия).
Графические формулы средних солей:
Na2CO3 AlPO4

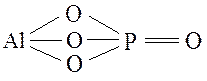
NaNO3 CaCl2


Al2(SO4)3 Ca3(PO4)2
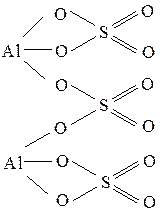

Химические свойства.
1. Взаимодействуют с кислотами, если выполняется одно из условий протекания реакций ионного обмена:
3CaCl2 + 2Н3PO4 = Ca3(PO4)2↓ + 6НCl;
AgNO3 + НCl = AgCl↓ + НNO3.
2. Взаимодействуют со щелочами, если выполняется одно из условий протекания реакций ионного обмена:
Mg(NO3)2 + 2KOH = Mg(OH)2↓ + 2KNO3;
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH.
3. Взаимодействуют в растворах с солями, если выполняется одно из условий протекания реакций ионного обмена:
Pb(NO3)2 + K2SO4 = PbSO4↓ + 2KNO3;
CаCl2 + (NH4)2CO3 = CаCO3↓ + 2NH4Cl.
4. Растворы солей взаимодействуют с металлами, более активными, чем металл, входящий в состав соли (кроме щелочных и щелочноземельных металлов, которые энергично взаимодействуют с водой):
CuCl2 + Zn = Cu↓ + ZnCl2;
CuSO4 + Fe = Cu↓ + FeSO4.
5. Взаимодействуют с кислотными оксидами, если в реакции выделяется газообразный оксид:
t
K2CO3 + SiO2 = K2SiO3 + CO2↑;
t
CaSO3 + SO3 = CaSO4 + SO2↑.
6. При нагревании большинство солей разлагается:
t
CaCO3 = CaО + CO2,
(карбонаты щелочных металлов, кроме карбоната лития, при нагревании плавятся без разложения);
t
CuSO4 = CuO + SO3,
(сульфаты щелочных металлов при нагревание плавятся без разложения).
t
2KNO3 = 2KNO2 + O2;
t
2Cu(NO3)2 = 2CuO + 4NO2 + O2;
t
2AgNO3 = 2Ag + 2NO2 + O2.
Кислые соли (гидросоли) – это продукты неполного замещения атомов водорода в молекуле многоосновной кислоты на атомы металла (или аммонийную группу). Кислые соли образуются при избытке кислоты или кислотного оксида, которому соответствует многоосновная кислота.
Названия кислых солей образуются прибавлением приставки гидро - к названию средней соли.
NaOH + H2SO4 = NaHSO4 + H2O;
гидросульфат натрия или
тетраоксогидросульфат (VI) натрия
Ca(OH)2 + 2H2CO3 = Ca(HCO3)2 + 2H2O;
гидрокарбонат кальция или
триоксогидрокарбонат (IV) кальция
Сa(OH)2 + 2H3PO4 = Ca(H2PO4)2 + 2H2O;
дигидрофосфат кальция или
тетраоксодигидрофосфат (V) кальция
Сa(OH)2+ H3PO 4 = CaHPO4 + 2H2O.
гидрофосфат кальция или
тетраоксогидрофосфат (V) кальция
С точки зрения теории электролитической диссоциации кислые соли – это электролиты, которые в растворах и расплавах диссоциируют с образованием катионов металла (или аммония) и сложного аниона, при дальнейшей диссоциации которого образуются ионы Н+.
NaHSO4 = Na+ + HSO4- (по типу сильного электролита);
HSO4- = H+ + SO42- (по типу слабого электролита);
Al(H2PO4)3 = Al3+ + 3H2PO4- (по типу сильного электролита);
3H2PO4- = 3H+ + 3HPO42-(по типу слабого электролита);
3HPO42- = 3H+ + 3PO43- (по типу слабого электролита).
Графические формулы кислых солей:
NaHSO4 CaHPO4


Химические свойства.
1. Кислые соли взаимодействуют с основаниями и превращаются в средние соли:
NaHSO4 + NaOH = Na2SO4 + H2O;
Ca(H2PO4)2 + 2Ca(OH)2 = Ca3(PO4)2 + 4H2O;
2NaHCO3 + Ba(OH)2 = BaCO3 + Na2CO3 + 2H2O.
2. Кислые соли взаимодействуют с кислотами если:
а) образуется более летучая или слабая кислота:
NaHCO3 + HCl = NaCl + CO2↑ + H2O;
б) образуется более кислая соль:
Na2HPO4 + H3PO 4 = 2NaH2PO4.
3. Кислые соли вступают в реакции обмена с другими солями, если выполняется одно из условий протекания реакций ионного обмена:
Ba(HCO)3 + Na2SO4 = BaSO4 + 2NaHCO3.
Основные соли – это продукты неполного замещения гидроксогрупп в молекуле многокислотного основания на кислотный остаток. Основные соли образуются при избытке основания.
Названия основных солей образуются путем прибавления к названию соответствующей средней соли приставки гидроксо:
Ca(OH)2 + HCl = CaOHCl + H2O;
гидроксохлорид кальция
или хлорид гидроксокальция
2Сr(OH)3 + H2SO4 = (Cr(OH)2)2SO4 + 2H2O;
дигидроксосульфат хрома (III),
сульфат дигидроксохрома (III) или
тетраоксосульфат (VI) дигидроксохрома (III)
Сr(OH)3 + H2SO4 = CrOHSO4 + 2H2O.
гидроксосульфат хрома (III),
сульфат гидроксохрома (III) или
тетраоксосульфат (VI) гидроксохрома (III)
С точки зрения теории электролитической диссоциации, основные соли – это электролиты, которые диссоциируют на сложный катион и анион кислотного остатка. При дальнейшей диссоциации сложного катиона образуются гидроксид-ионы ОН-.
CaOHCl = CaOH+ + Cl-(по типу сильного электролита)
CaOH+ = Ca2+ + OH-(по типу слабого электролита)
Графические формулы основных солей:
(Cr(OH)2)2SO4 CuOHNO3
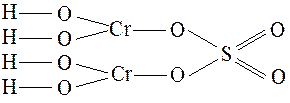
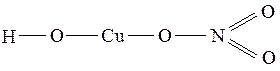
Химические свойства.
1. Основные соли взаимодействуют с кислотами и превращаются в средние соли:
2CrOHSO4 + H2SO4 = Cr2(SO4)3 +2H2O
2. Основные соли взаимодействуют со щелочами, если:
а) образуется более основная соль:
2AlOHSO4 + 2NaOH = (Al(OH)2)2SO4 + Na2SO4
б) образуется труднорастворимое основание:
MgOHCl + NaOH = Mg(OH)2 + NaCl
3. Основные соли вступают в реакции обмена с другими солями, если выполняется одно из условий протекания реакций ионного обмена:
(CaOH)2SO4 + BaCl2 = BaSO4 + 2CaOHCl
Двойные соли – это сложные вещества, состоящие из атомов 2-х различных металлов и остатка одной кислоты. Например, KNaCl2 (KCl∙NaCl) – хлорид калия, натрия (сильвинит), KAl(SO4)2 – сульфат калия, алюминия
При электролитической диссоциации двойные соли образуют катионы металлов и анионы кислотного остатка:
KAl(SO4)2 = K++ Al3+ + 2SO42-. 
Смешанные соли – этосложные вещества, состоящие из атомов одного металла и остатков двух различных кислот. Например: Cа(ClO)Cl – хлорид-гипохлорит кальция.
При электролитической диссоциации смешанные соли образуют катионы металла и анионы кислотного остатка:
Cа(ClO)Cl = Cа2+ + ClO- + Cl-.
Комплексные соли – сложные вещества, содержащие в своем составе сложный комплексный ион, способный к самостоятельному существованию в водных растворах или расплавах. Например, Na3[Al(OH)6] – гексагидроксоалюминат натрия;
[Ag(NH3)2]Cl – хлориддиаммин серебра (I);
K3[Fe(CN)6] – гексацианоферрат (III) калия.
Строение комплексных соединений:

 Na3+ [Fe(CN)6]3-
Na3+ [Fe(CN)6]3-
 |  |  | |||
внешняя сфера внутренняя сфера координационное число
комплексообразователь лиганды
Суммарный заряд внутренней сферы (сумма заряда комплексообразователя и общего заряда лигандов) компенсируется зарядом внешней сферы.
Комплексообразование в большей степени характерно для переходных металлов, т.е. для d-элементов и почти не характерно для s-элементов.
Координационное число зависит от заряда комплексообразователя.
В большинстве случаев сохраняется следующая зависимость (таблица 1).
Таблица – 1 Координационные числа комплексообразователя
| Степень окисления комплесообразователя | +1 | +2 | +3 | +4 |
| Координационное число | 6; 4 | 8; 6 |
При электролитической диссоциации в растворах или расплавах комплексные соли образуют комплексный ион и ион внешней сферы (по типу сильного электролита). Затем дальнейшей диссоциации подвергается комплексный ион (по типу слабого электролита):
Na2[Zn(OH)4] = 2Na+ + [Zn(OH)4]2-,
[Zn(OH)4]2- = Zn(OH)3- + OH-,
Zn(OH)3- = Zn(OH)2 + OH-,
Zn(OH)2 = ZnOH+ + OH-,
ZnOH+ = Zn2+ + OH-.
Cуммарное уравнение процесса диссоциации комплексного иона:
[Zn(OH)4]2- = Zn2 + + 4ОН-.






