1. Пространственные изомеры отличаются: а) конфигурацией; б) конформацией; в) качественным составом; г) количественным составом; д) числом хиральных центров.
2. Энантиомеры - это изомеры, отличающиеся: а) числом хиральных центров; б) конфигурацией у всех хиральных центров; в) конфигурацией у некоторых хиральных центров; г) конформацией; д) положением двойной связи.
3. Диастереомеры ‑ это стереоизомеры, различающиеся: а) конфигурацией заместителей у всех хиральных центров; б) конфигурацией заместителей у некоторых хиральных центров; в) знаком вращения; г) числом хиральных центров; д) конформацией.
4. Причиной возникновения оптической активности у вещества является: а) симметричность молекулы; б) несимметричность молекулы; в) способность вращать плоскость плоскополяризованного света; г) отсутствие двойных связей в молекуле; д) отсутствие хирального центра.
5. Причиной существования конформационных изомеров является:
а) наличие в молекуле двойной связи; б) наличие в молекуле циклической структуры; в) невозможность вращения вокруг p‑связи; г) возможность свободного вращения вокруг s-связи; д) отсутствие хирального центра.
6. Символ «+» в названии органического соединения обозначает, что: а) вещество имеет D‑конфигурацию; б) вещество имеет R‑конфигурацию; в) старшинство заместителей в формуле Фишера убывает направо; г) старшинство заместителей в формуле Фишера возрастает направо; д) вещество поворачивает плоскость плоскополяризованного света направо.
7. Символ «-» в названии органического соединения обозначает, что: а) вещество имеет L‑конфигурацию; б) вещество имеет S‑конфигурацию; в) старшинство заместителей в формуле Фишера убывает по часовой стрелке; г) старшинство заместителей в формуле Фишера возрастает по часовой стрелке; д) вещество поворачивает плоскость плоскополяризованного света налево.
8. Символ «R» в названии органического соединения обозначает, что: а) старшинство заместителей в формуле Фишера возрастает по часовой стрелке; б) старшинство заместителей в формуле Фишера убывает по часовой стрелке; в) вещество левовращающее; г) вещество правовращающее; д) вещество оптически неактивно.
9. Смесь равных количеств антиподов называется: а) рацемической; б) энантиомеры; в) диастереомеры; г) трео‑форма; д) эритро‑форма.
10. Причиной оптической неактивности мезо‑формы является: а) симметричность молекулы; б) несимметричность молекулы; в) отсутствие хиральных центров; г) наличие четного числа хиральных центров; д) наличие нечетного числа хиральных центров.
В заданиях 11‑17 несколько ответов являются верными. Напишите букву, соответствующую правильной комбинации ответов:
А ‑ если верно 1,3,5
Б ‑ если верно 2,4,5
В ‑ если верно 1,3
Г ‑ если верно 2,4
Д ‑ если верно всё.
11. И структурная и пространственная изомерия возможна для: 1) 2-хлорпропана; 2) 2-хлорбутана; 3) 1,1-дихлорбутена-1; 4) бутена-2; 5) 1-хлорбутена-2.
12. В виде энантиомеров могут существовать следующие вещества: 1) бутан; 2) 2‑нитробутан; 3) пентанол‑1; 4) пентанол‑2; 5) 3‑иодпентан.
13. В виде s‑диастереомеров могут существовать следующие вещества: 1) 2‑хлорпентан; 2) 2,3‑дихлорбутан; 3) 2,2‑дихлорбутан; 4) 2,4‑дихлорпентан; 5) 2‑бром‑3-хлорпентан.
14. В виде p‑диастереомеров могут существовать следующие вещества: 1) бутен‑2; 2) бутен‑1; 3) пентен‑2; 4) пентин‑2; 5) 1‑хлор‑бутен‑2.
15. Мезоформу могут иметь следующие соединения: 1) 3,4‑диметилгексан; 2) 3,3‑диметилгексан; 3) 2,3‑дибромбутан; 4) 2,3‑дибромпентан; 5) 3‑метилгексан.
16. D‑конфигурацию имеют следующие соединения:

17. S‑конфигурацию имеют следующие соединения:

В заданиях 18‑21 вместо прочерков написать нужную цифру:
18. Число стереоизомеров для бутанола‑2 равно...
19. Число стереоизомеров для 2‑бром‑3‑иодбутана равно...
20. Число стереоизомеров для 2,3‑дихлорбутана равно...
21. Число геометрических изомеров для гексена‑3 равно...
В заданиях 22‑25 закончить ответы:
22. R‑2‑иодпропаналь имеет следующую проекционную формулу Фишера...
23. L-2‑аминопропановая кислота имеет следующую проекционную формулу Фишера...
24. Z-1,4‑дихлорбутен‑2 имеет следующую формулу...
25. С учетом пространственного расположения заместителей
| вещество | в E,Z –системе называется… |
Ответы
| 1. а 2. б 3. б 4. б 5. г | 6. д 7. д 8. б 9. а 10. а | 11. б 12. г 13. б 14. а 15. в | 16. в 17. д 18. 2 19. 4 20. 3 21. 2 | |||
| 22. | 
| 23. | 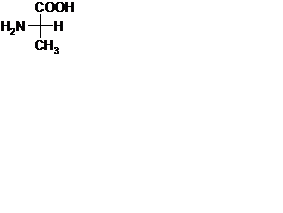
| |||
| 24. | 
| 25. Е‑бутен‑2. | ||||
Глава 7. Вопросы к блоку № 1
1. Явление гибридизации в органической химии. sр3‑Гибридизация атома углерода. Электронное строение алканов. Прогнозирование реакционной способности на основе анализа их строения. Ответ подтвердить примерами.
2. Явление гибридизации в органической химии. sр2‑Гибридизация атома углерода. Электронное строение двойной углерод‑углеродной связи. Прогнозирование реакционной способности алкенов на основе анализа их строения. Ответ подтвердить примерами.
3. Явление гибридизаций в органической химии. sр‑Гибридизация атома углерода. Электронное строение тройной углерод‑углеродной связи. Прогнозирование реакционной способности алкинов на основе анализа их строения. Ответ подтвердить примерами.
4. Типы химических связей в органических соединениях. Ковалентные s и p‑связи. Строение одинарных, двойных, тройных углерод-углеродных связей, их важнейшие характеристики (длина, энергия). Причины появления СН‑кислотного центра в алкинах с концевой тройной связью.
5. Типы разрыва ковалентных связей. Электронное и пространственное строение частиц, образующихся при гомолитическом (свободные радикалы) и гетеролитическом (карбанионы, карбкатионы) разрыве связи. Факторы, определяющие их относительную устойчивость. Трет‑бутильные, аллильные, бензильные радикалы и ионы.
6. Химические свойства алканов. Реакции радикального замещения у тетрагонального атома углерода, механизм (на примере реакции галогенирования). Нитрование алканов по Коновалову.
7. Химические свойства алкенов. Реакции электрофильного присоединения, механизм. Роль кислого катализа в реакциях гидратации. Правило Марковникова и его объяснение с помощью электронных представлений.
8. Химические свойства алкинов. Реакции электрофильного присоединения как наиболее характерные. Реакция Кучерова. Причины появления СН‑кислотного центра в алкинах с концевой тройной связью.
9. Способы получения алканов, алкенов, алкинов. Природные источники углеводородов.
10. Циклоалканы. Особенности строения и химического поведения малых циклов. Понятие о t‑связи. Получение циклоалканов. Конформации циклоалканов.
11. Понятие о сопряжении; p,p‑сопряжение. Системы с открытой (бутадиен‑1,3) и замкнутой (бензол) системами сопряжения. Энергия сопряжения. Влияние сопряжения на реакционную способность сопряженных систем.
12. Арены. Электронное строение бензола. Понятие об ароматичности. Правило Хюккеля. Влияние ароматичности на реакционную способность бензола.
13. Электронное строение бензола. Прогнозирование реакционной способности бензола на основе анализа строения. Реакции электрофильного замещения как наиболее характерные в ряду аренов (галогенирование, нитрование, сульфирование, алкилирование, ацилирование). Механизм SE реакций, строение p‑ и s‑комплексов. Пути образования электрофильных частиц в вышеназванных реакциях.
14. Взаимное влияние атомов в молекулах органических соединений. Индуктивный и мезомерный эффекты. Правила ориентации в бензоле. Заместители 1 и 2 рода. Механизм их влияния на реакционную способность бензола. Понятие о р,p- и p,p‑сопряжении.
15. Понятие об ароматичности. Правило Хюккеля. Критерии ароматичности. Ароматичность конденсированных аренов, их реакционная способность на примере нафталина. (Реакции, идущие с сохранением и нарушением ароматичности).
16. Способы получения бензола, нафталина и их гомологов. Реакции Вюрца‑Фиттига и Фриделя‑Крафтса. Природные источники получения ароматических соединений.
17. Методы идентификации алканов, алкенов, алкинов, алкадиенов, аренов химическим путем и с помощью ИК‑спектроскопии.
18. Явление изомерии в органической химии. Виды изомерии. Понятие о хиральном центре. Энантиомерия соединений с одним центром хиральности. Относительная и абсолютная конфигурации. D‑, L‑ и R‑, S‑стереохимические ряды.
19. Понятие о пространственной изомерии. Хиральные молекулы. Соединения с одним и двумя центрами хиральности. Энантиомеры, диастереомеры (s-и p-диастереомеры). Рацематы. Мезоформа. Z, Е‑система обозначения конфигурации у p‑диастереомеров.




