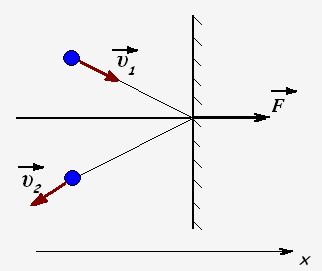
Молекулы газа при столкновении со стенками взаимодействуют с ними как упругие тела и передают стенкам свои импульсы. Проекция импульса силы, действующей на стенку со стороны одной молекулы равен
Fx· t = 2m0 · υx
Пусть за время t о стенку ударяется N частиц, тогда они передадут стенке импульс
N · Fx· t = 2m0 · υx· N
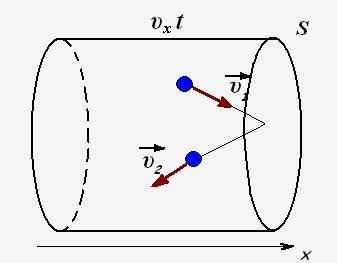
Число ударяющих о стенку молекул можно определить через концентрацию частиц и объем сосуда:
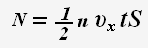
Тогда для проекции импульса силы получаем выражение:
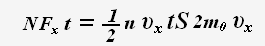
По определению давления:

Так как все направления движения частиц равновероятны, то для проекции скорости справедливо равенство:
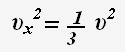
Основное уравнение молекулярно-кинетической теории:
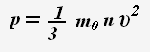
Это уравнение устанавливает связь между микро- и макропараметрами.
Уравнение состояния идеального газа.
Давление газа пропорционально концентрации молекул и его абсолютной температуре

где k=1,38 · 10-23Дж/К -постоянная Больцмана, n -концентрация молекул, Т - абсолютная температура.
Используем равенства для концентрации и числа молекул газа

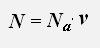
получаем:
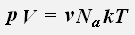

где R = 8,31 Дж/(моль·К) - универсальная газовая постоянная
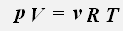
С учетом того, что количество вещества можно определить, зная массу газа и его молярную массу, получаем уравнение состояния идеального газа:

Уравнение состояния идеального газа можно переписать в виде:
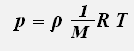
где ρ -плотность газа.
Изопроцессы.
Изопроцесс - процесс, который происходит с данной массой газа при одном неизменном параметре - температуре, давлении, объёме, а так же при отсутствии теплообмена с окружающей средой.
Используя уравнение состояния идеального газа, для заданной массы заданного газа получаем:
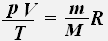
Тогда для двух состояний данной массы газа имеет место равенство:

1.Изотермический процесс - процесс протекающий при неизменной температуре.
С учётом того, что температура неизменна, получаем:
 или
или 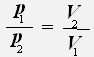
Закон Бойля-Мариотта: Для данной массы газа при постоянной температуре давление газа обратно пропорционально его объему.
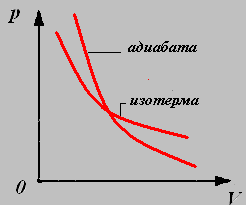
График изотермического процесса называют изотермой.
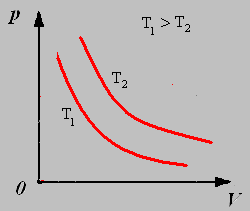
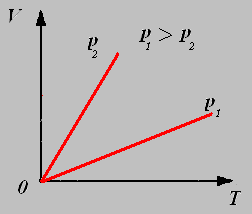
2.Изохорный процесс - процесс протекающий при неизменном объёме.
С учётом того, что объём газа не меняется, получаем:
 или
или 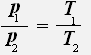
Закон Шарля: Для данной массы газа при постоянном объёме давление газа прямо пропорционально его абсолютной температуре.
График изохорного процесса называют изохорой.

3.Изобарный процесс - процесс протекающий при неизменном давлении.
С учётом того, что давление газа не меняется, получаем:
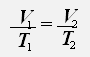 или
или 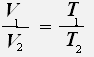
Закон Гей-Люссака: Для данной массы газа при постоянном давлении объём газа прямо пропорционален его абсолютной температуре.
График изобарного процесса называют изобарой.
4. Адиабатный процесс-процесс, происходящий в системе без теплообмена с окружающими телами.
Параметры давления и объёма связаны уравнением Пуассона:
 , где γ -показатель адиабаты,
, где γ -показатель адиабаты, 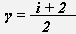 .
.
График адиабатного процесса называют адиабатой.