Следует указать на роль пористой перегородки. Ее назначение заключается лишь в том, чтобы воспрепятствовать не посредственному действию медного купороса на цинк. При непосредственном дей ствии медного купороса на цинк энергия реакции выделилась бы в виде теплоты в самом гальваническом элементе, вместо того чтобы превратиться в электрический ток. В некоторых конструкциях гальва нических элементов пористая перегород ка не нужна. Она не была бы нужна и в рассмотренном элементе Даниэля, если бы применяемый в нем цинк был идеально чист; химически чистый цинк, как показывает опыт, не взаимодействует с медным купоросом при непосредственном соприкосновении. Скопившиеся вблизи поверхности цинка в двойном слое положительные ионы цинка отталкивают одноименно заряженные ионы меди и препятствуют их соприкосновению с металлическим цинком.
Понятие об электродном потенциале.
Если опустить металлическую пластинку в воду, то поверхностные ионы Me будут взаимодействовать с полярными молекулами воды. Полярные молекулы воды атакуют пов-ть пластинки. В рез-те в водную среду переходят ионы Ме, поэтому на границе раздела 2х фаз Ме/жидкость образуется двойной электрический слой, состоящий из ионов Ме и электронов избытка металлической пластины. На границе Ме/раствор возникает двойной электрический слой и устанавливается равновесие.
Ме+mH2O 
или не включая гидратационную воду
Ме 
Электродный потенциал металла - представляет собой разность потенциалов на границе металл-раствор. Им определяется состояние равновесия электродного процесса.  . Величина электродного потенциала зависит от свойств металла, концентрации ионов данного металла в растворе и температуры. Эта зависимость выражается ур-ем Нернста:
. Величина электродного потенциала зависит от свойств металла, концентрации ионов данного металла в растворе и температуры. Эта зависимость выражается ур-ем Нернста:
 Для достаточно разбавленных растворов
Для достаточно разбавленных растворов  .
.  -концентрация
-концентрация
R=8.314 Дж К-1 моль-1 унив.газ.постоянная
F=96487 Кл моль-1 число Фарадея
n – заряд иона металла.
 - стандартный электродный потенциал.
- стандартный электродный потенциал.
Водородный электрод.
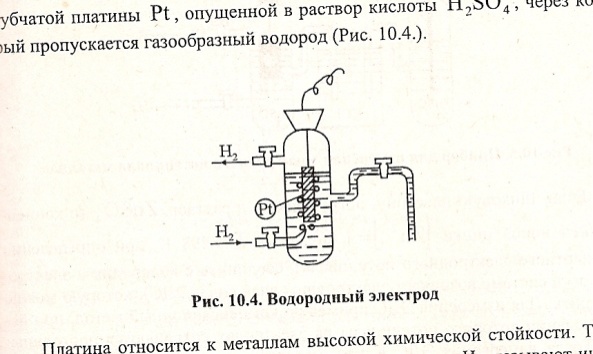 Электродные потенциалы измеряют по отношению к нормальному водородному электроду. Водородный электрод представляет собой пластину из губчатой пластины Pt, опущенной в раствор кислоты H2SO4, через который пропускается газообразный водород. Платина относится к металлам высокой химической стойкости. Газообразный водород адсорбируется на поверхности Pt. Для увеличения адсорбирующей способности ее покрывают слоем губчатой платины. На поверхности платины, насыщенной водородом, устанавливается равновесие:
Электродные потенциалы измеряют по отношению к нормальному водородному электроду. Водородный электрод представляет собой пластину из губчатой пластины Pt, опущенной в раствор кислоты H2SO4, через который пропускается газообразный водород. Платина относится к металлам высокой химической стойкости. Газообразный водород адсорбируется на поверхности Pt. Для увеличения адсорбирующей способности ее покрывают слоем губчатой платины. На поверхности платины, насыщенной водородом, устанавливается равновесие:
Н2 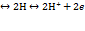 Абсолютное значение водородного электрода неизвестно, но условно считают, что потенциал стандартного водородного электрода равен нулю.
Абсолютное значение водородного электрода неизвестно, но условно считают, что потенциал стандартного водородного электрода равен нулю.  =0, когда
=0, когда  =101325 Па(760мм РТ.ст.) Т=298 К(25° С) [
=101325 Па(760мм РТ.ст.) Т=298 К(25° С) [  ]=1 моль/л
]=1 моль/л






