Задача №4.
Раствор, нормальная концентрация которого равна СН, имеет плотность ρ. Определить молярную и процентную концентрацию раствора.
Численные значения СН и ρ: 2 моль-экв/л, ρ = 1,06 г/см3.
Растворенное вещество – серная кислота H2SO4.
Решение.
Нормальная и молярная концентрации связаны следующим соотношением:
СН = z·CM,
Где CM – молярная концентрация; z – число эквивалентности, для кислот равно основности кислоты.
Значит, молярная концентрация будет равна:
CM =  =
=  = 1 (моль/л).
= 1 (моль/л).
Возьмем 1 л раствора. Тогда в нем будет содержаться 1 моль H2SO4. Масса серной кислоты будет равна:
m(H2SO4) = M(H2SO4)·n(H2SO4) = 98 г/моль · 1 моль = 98 г.
Масса 1 литра раствора составит:
m(p-pa H2SO4) = ρ·V = 1,06 г/см3 ·1000 см3 = 1060 г.
Массовая доля серной кислоты в растворе составит:
W(H2SO4) =  =
=  = 9,26%.
= 9,26%.
Задача № 23.
Рассматриваются растворы 2-х электролитов, молярная концентрация каждого из которых равна СМ. Определить силу электролитов и записать уравнения их диссоциации. Назвать электролиты.
Для сильного электролита определить молярную концентрацию каждого иона, считая, что он диссоциирует полностью.
Для слабого электролита записать выражение константы диссоциации и определить значение степени диссоциации α, если величина его константы диссоциации равна КKnAm.
Определите значение рН растворов сильного и слабого электролита.
Численные значения СМ, КKnAm: СМ – 0,1 моль/л; КKnAm - 6·10-10.
Электролиты: [Hg(NH3)4](OH)2 и HAsO2.
Решение.
[Hg(NH3)4](OH)2 – гидроксид тетраамминртути (II), сильный электролит. Диссоциирует согласно уравнению:
[Hg(NH3)4](OH)2 → [Hg(NH3)4]2+ + 2ОН-
HAsO2 – мышьяковистая кислота, слабый электролит. Уравнение диссоциации имеет вид:
HAsO2 ↔ H+ + AsO2-
Если считать, что гидроксид тетраамминртути диссоциирует полностью, то молярная концентрация каждого иона составит:
С([Hg(NH3)4]2+ ) = СМ = 0,1 моль/л, а С(ОН-) = 2· СМ = 2·0,1 моль/л = 0,2 моль/л.
Выражение для константы диссоциации мышьяковистой кислоты:
КKnAm  .
.
Степень диссоциации рассчитывается по формуле:
 =
= 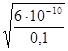 = 7,7·10-5.
= 7,7·10-5.
Для гидроксида тетраамминртути сначала найдем рОН:
рОН = -lg[OH-] = -lg0,2 = 0,7
pH = 14 – pOH = 14 – 0,7 = 13,3.
Для мышьяковистой кислоты концентрация ионов водорода составит:
[H+] = СМ·  = 0,1·7,7·10-5 = 7,7·10-6.
= 0,1·7,7·10-5 = 7,7·10-6.
рН = -lg[H+] = -lg(7,7·10-6) = 5,1.
Задача № 44.
Составить молекулярные и ионно-молекулярные уравнения реакций между следующими веществами:
А) хлорид натрия и сульфат калия; б) хлорид железа (III) и гидроксид калия; в) гидроксид цинка и серная кислота.
Если какая-либо из реакций не протекает, объяснить, почему.
Решение.
А) реакция не идет, так как не соблюдаются условия протекания обменных реакций до конца, а именно не выпадает осадок, не выделяется газ, не образуется малодиссоциирующее вещество.
Б) FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl - молекулярное уравнение,
Fe3+ + 3Cl- + 3K+ + 3OH- → Fe(OH)3↓ + 3K++ 3Cl- - полное ионно-молекулярное уравнение,
Fe3+ + 3OH- → Fe(OH)3↓ - сокращенное ионно-молекулярное уравнение.
В) Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O - молекулярное уравнение,
Zn(OH)2 + 2H+ + SO42- → Zn2+ + SO42- + 2H2O - полное ионно-молекулярное уравнение,
Zn(OH)2 + 2H+ → Zn2+ + 2H2O - сокращенное ионно-молекулярное уравнение.
Задача № 63.
Составить по два молекулярных уравнения для каждой из следующих реакций ионного обмена:
А) Ca2+ + CO32- = CaCO3; б)HNO2 + OH- = NO2- + H2O.






