ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
СТЕПЕНЬ ОКИСЛЕНИЯ И СОСТАВЛЕНИЕ
ХИМИЧЕСКИХ ФОРМУЛ
Состав химических соединений выражают химическими формулами, при составлении которых используется характеристика состояния элемента в соединении – степень окисления (с. о.).
| Степень окисления – условный заряд атома в химическом соединении. |
Степень окисления при необходимости указывают над символом элемента в формуле или римской цифрой в названии вещества.
Для расчета степеней окисления элементов используют следующие правила:
v степень окисления элемента в простом веществе равна нулю 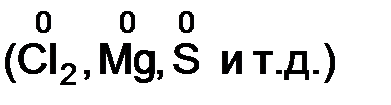 ;
;
v степень окисления кислорода в большинстве сложных веществ равна -2 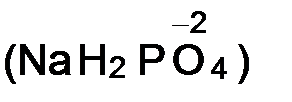 ;
;
v степень окисления водорода и щелочных металлов в большинстве сложных веществ равна +1 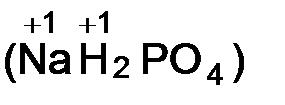 ;
;
v алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, в ионе – его заряду.
Пример. Рассчитайте степени окисления элементов в соединениях: а) NH3; б) P2O5; в) NH4NO3.
Решение
а) С. о. водорода равна +1. С. о. азота рассчитываем, приравнивая алгебраическую сумму с. о. атомов, образующих данную молекулу, нулю. Сумма с.о. атома азота (x) и трех атомов водорода 3(+1)
x + 3(+1) = 0, откуда x = -3. 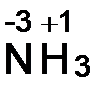 .
.
б) С.о. кислорода равна -2. Аналогично предыдущему составляем выражение алгебраической суммы с.о. двух атомов фосфора (2х) и пяти атомов кислорода:
2х + 5(-2) = 0, откуда х = +5. 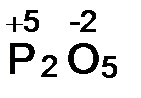 .
.
в) Большинство элементов в соединениях проявляют несколько различных степеней окисления. Рассчитать степени окисления атомов азота в соединении NH4NO3 можно, разделив эту соль на ионы NH4+ и NO3-. Далее для каждого иона составляем выражение суммы степеней окисления, включая неизвестную степень окисления атома азота х, и приравниваем его заряду иона.
Для иона NH4+:
х + 4 (+1) = +1, х = -3;
для иона NO3-:
х + 3(-2) = -1, х = +5.
Формула нитрата аммония с указанием с. о. азота: 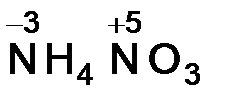 .
.
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Химические вещества могут быть простыми и сложными. Среди простых веществ выделяют металлы и неметаллы (см. далее). Граница между металлами и неметаллами размыта, выделенные элементы проявляют двойственность свойств.
| (H) | Металлы Неметаллы | H | He | ||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La* | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac** | Ku |
La* – первый элемент семейства лантаноидов (14 лантаноидов),
Ас** – первый элемент семейства актиноидов (14 актиноидов).
Сложные неорганические соединения делят на три основных класса – оксиды, гидроксиды и соли.
Оксиды
| Оксиды – соединения элементов с кислородом. |
Если элементы проявляют переменную с.о., то образуют оксиды различного состава, что учитывают в названии оксида указанием с.о. элемента. Если элемент образует один оксид, то в названии оксида с.о. не указывают.
Например, Al2O3 – оксид алюминия (алюминий проявляет единственную с. о., равную +3); N2O3 – оксид азота (III) (азот проявляет различные с. о., в данном оксиде с. о. азота равна +3).
| Оксиды делят на несолеобразующие и солеобразующие. |
Несолеобразующиеоксиды весьма немногочисленны – например CO, NO, N2O.
| Солеобразующие оксиды по химическим свойствам делят на три группы – основные, кислотные и амфотерные. |
Основные оксиды образуют только типичные металлы в степени окисления +1, +2 (не всегда), +3 (редко).
Кислотные оксиды образуют неметаллы, а также металлы в высоких степенях окисления (+6, +7). Оксиды неметаллов ‑ SO2,P2O5, оксиды металлов – 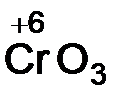 ,
, 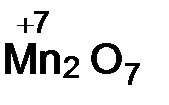 .
.
Амфотерные оксиды образуют металлы в степени окисления +3, +4, +5, иногда +2, а также элементы, расположенные вблизи условной диагонали, разделяющей металлы и неметаллы (As ‑ As2O3, Sb ‑ Sb2O3). Амфотерные оксиды некоторых металлов в степени окисления +2 –ZnO, PbO, SnO, BeO – полезно запомнить. Амфотерные оксиды сочетают свойства основных и кислотных оксидов.
Химические свойства оксидов
v Отношение к воде
Из основных оксидов с водой реагируют только оксиды щелочных (IА подгруппа) и щелочноземельных (IIА подгруппа, кроме Be и Mg) металлов, в результате образуются растворимые основные гидроксиды
BaO + H2O = Ba(OH)2.
Большинство кислотных оксидов реагируют с водой, в результате образуются растворимые кислотные гидроксиды (кислоты)
SO3 + H2O = H2SO4.
Некоторые кислотные оксиды, в том числе SiO2, с водой не реагируют.
Амфотерные оксиды с водой не реагируют.
v Кислотно-основные взаимодействия
Оксиды вступают в кислотно-основные взаимодействия, в результате которых образуются соли. Реагируют только вещества, одно из которых проявляет кислотные свойства, а другое ‑ основные
MgO + SiO2 = MgSiO3,
основной кислотный соль
оксид оксид
BaO + Al2O3 = Ba(AlO2)2,
основной амфотерный соль
оксид оксид
BaO + 2HNO3 = Ba(NO3)2 + H2O,
основной кислота соль
оксид
N2O5 + PbO = Pb(NO3)2,
кислотный амфотерный соль
оксид оксид
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
кислотный основание соль
оксид
ZnO + H2SO4 = ZnSO4 + H2O,
амфотерный кислота соль
оксид
ZnO + 2NaOH = Na2ZnO2 + H2O.
амфотерный основание соль
оксид (щелочь)
Амфотерные оксиды в реакциях с кислотами и кислотными оксидами проявляют основные свойства, в реакциях со щелочами и основными оксидами – кислотные свойства.
Гидроксиды
| Гидроксиды – соединения, в состав которых входят элемент (Э), кроме фтора и кислорода, и гидроксогруппа OH. |
Общая формула гидроксидов – Э(OH)n, где n равно степени окисления элементаи принимает значения 1÷6. При n > 2 гидроксиды могут существовать в разных гидратных орто- и мета- формах. Переход орто-формы в мета-форму можно представить как потерю (вычитание) одной или двух молекул воды, например:
Э(ОН)3 ® ЭOOH + H2O
орто- мета-
форма форма
Метаформы гидроксидов содержат в своем составе, кроме гидроксогрупп, атомы кислорода.
| Гидроксиды делят на три группы – основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные. |
Каждому солеобразующему оксиду соответствует гидроксид, причем в паре оксид - соответствующий гидроксид одинаковы кислотно-основной характер соединений и их отношение к воде.
Na2O – основной оксид, реагирует с водой,
NaOH – основание, растворимое в воде.
SiO2 – кислотный оксид, нерастворимый в воде,
H2SiO3 – кислота, в воде не растворяется.
SnO – амфотерный оксид, нерастворимый в воде,
Sn(OH)2 – амфотерный гидроксид, нерастворимый в воде.
Основания. Основания– гидроксиды, которые в водных растворах диссоциируют (распадаются) с образованием гидроксид-ионов (OH-).
Основания образуют элементы, соответствующие оксиды которых имеют основной характер. Название оснований составляют из слова ‘‘гидроксид’’ и названия элемента с указанием степени окисления, если степень окисления переменна, например: Ca(OH)2 – гидроксид кальция, Fe(OH)3 – гидроксид железа (III).
По растворимости в воде основания делят на две группы – растворимые (щелочи) и нерастворимые. Растворимые основания образуют щелочные и щелочноземельные металлы (прил. 3).
Кислоты. Кислоты – соединения, которые в водных растворах диссоциируют с образованием ионов водорода (H+). В формулах кислот атомы водорода ставят на первое место: НnЭOm.
Кислоты имеют традиционные названия, которые производят от русского названия центрального атома с прибавлением различных суффиксов и окончаний, которые определяются степенью окисления центрального атома:
H2SO4 – серная кислота;
H2SO3– сернистая кислота;
HClO4 – хлорная кислота;
HClO – хлорноватистая кислота.
В класс гидроксидов не входят бескислородные кислоты (H2S, HF, HCl, HBr, HI), их называют соответственно сероводородной, фтороводородной, хлороводородной (соляной), бромоводородной, йодоводородной кислотами.
Амфотерные гидроксиды. Амфотерные гидроксиды обладают свойствами оснований и кислот. Формулы и названия амфотерных гидроксидов принято составлять аналогично формулам оснований, однако для удобства им можно придать и форму кислот:
Zn(OH)2 – гидроксид цинка (или H2ZnO2 – цинковая кислота).
Амфотерные гидроксиды нерастворимы в воде.






