Приборы и принадлежности
Закрытый стеклянный баллон с краном, манометр, насос

рис. 1
Теория работы и описание прибора
Для вещества в любом агрегатном состоянии характерны понятия удельной (с) и молярной (С) теплоемкости. Удельной теплоемкостью вещества называется физическая величина, численно равная количеству теплоты, необходимой для нагревания единицы массы вещества на 1 Кельвин.
 (1)
(1)
Молярной теплоемкостью вещества называется физическая величина, численно равная количеству теплоты, необходимой для нагревания одного моля вещества на 1 Кельвин.
 (2)
(2)
Здесь Q – количество теплоты, которое было затрачено на нагревание вещества от температуры Т1 до Т2. DT = Т2 — Т1. Для вещества в газообразном состоянии величины удельной или молярной теплоёмкости газа существенно зависят от того, при каких условиях он нагревается: при постоянном объёме или при постоянном давлении.
В первом случае сообщенное газу тепло идёт только на увеличение внутренней энергии газа, так как объём газа не изменяется и поэтому не совершается работа расширения. Во втором случае требуётся дополнительное количество теплоты, необходимое для совершения работы расширения газа, так как неизменность давления обеспечивается увеличением объёма газа. Поэтому у газа различают две удельные и две молярные теплоёмкости: теплоёмкость при постоянном объёме и теплоемкость при постоянном давлении. Удельной (молярной) теплоемкостью газа при постоянном объёме сv (Cv), или при постоянном давлении сp (Cp) называется физическая величина, численно равная количеству теплоты, необходимой для нагревания единицы массы (моля) на 1 кельвин при постоянном объёме или при постоянном давлении соответственно. Между молярной и удельной теплоемкостями очевидно соотношение:
 ;
; 
где М — молярная масса газа.
Очевидно, что молярная теплоемкость газа при постоянном давлении больше молярной теплоёмкости при постоянном объёме,
так как  , а
, а  ,
,
где R — молярная (универсальная) газовая постоянная, численно равная работе расширения одного моля газа при нагревании его на один кельвин. Тогда 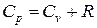 .
.
Обозначим отношение теплоёмкостей буквой g, тогда
 (3)
(3)
Величина g зависит только от числа степеней свободы молекул, из которых состоит газ. Так как  , а
, а 
где i — число степеней свободы, то
 (4)
(4)
Численное значение g различно для одно-, двух или многоатомных газов и зависит от числа степеней свободы (для одно атомных i = З, двухатомных i = 5 и многоатомных i = 6). На двухатомные газы (N2 и О2) приходится приблизительно 99% общего состава воздуха, поэтому величину i можно считать приближённо равной 5. Величина отношения теплоёмкостей g имеет большое значение в изучении адиабатных процессов и процессов близких к ним. Например, от этой величины зависит скорость распространения звука в газах, течение газов по трубам со сверхзвуковыми скоростями и другие процессы.
В настоящей работе определяется отношение теплоемкостей g для воздуха (принимая его за двухатомный газ) методом адиабатного расширения, который основан на применении уравнений адиабатного и изотермического процессов.
Адиабатным процессом называется изменение состояния газа, при котором не происходит теплообмена с окружающей средой. В этом случае  и формула первого закона термодинамики
и формула первого закона термодинамики  примет вид
примет вид  , т.е. при адиабатном процессе расширения газом совершается работа только расчет изменения запаса внутренней энергии. Этот процесс описывается уравнением Пуассона
, т.е. при адиабатном процессе расширения газом совершается работа только расчет изменения запаса внутренней энергии. Этот процесс описывается уравнением Пуассона
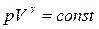 (5)
(5)
где р — давление и V — объём газа.
Изотермическим называется процесс, который протекает при постоянной температуре, те. Т = const.
В этом случае dT =0, следовательно, dU =0 и тогда из первого закона термодинамики получим  . Таким образом, при изотермическом процессе всё подводимое тепло расходуется на работу расширения газа.
. Таким образом, при изотермическом процессе всё подводимое тепло расходуется на работу расширения газа.
Экспериментальная установка состоит из стеклянного баллона А (рис. 11), соёдинённого с манометром В и насосом Н. Через кран К1 воздух нагнетается в баллон, а через кран К1 — выпускается. Если кран К2 открыт, баллон сообщается с атмосферным воздухом и давление р внутри него равно атмосферному, разность уровней манометра равна нулю, а температура Т в баллоне равна температуре окружающей среды. В процессе работы газ, заключенный в баллоне, проходит последовательно три состояния Если закрыть кран К2 и накачать в баллон небольшое количество воздуха, то давление в баллоне будет выше атмосферного, что отмечается возникновением разности уровней жидкости в манометре. При сжатии воздух в баллоне начнёт нагреваться, затем постепенно примет температуру окружающей среды, и тогда разность уровней в манометре будет устойчивой, равной р1. Давление воздуха в баллоне примет величину р+р1,
где р — атмосферное давление,
р1 — добавочное давление.
Таким образом, состояние воздуха внутри баллона, которое назовём I состоянием, характеризуется параметрами р + р1; V1 и T1. Если затем открыть кран К2, то часть воздуха выйдет из баллона и давление сравняется с атмосферным, температура газа понизится до Т2, а объём будет равен V2. Этот процесс расширения происходит очень быстро и может считаться адиабатным, так как за короткое время процесса не происходит теплообмена между воздухом в баллоне и окружающей средой. Состояние газа, соответствующее концу адиабатного процесса назовём П состоянием газа с параметрами р; V2 и Т2. Адиабатный процесс описывается
уравнением Пуассона 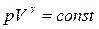 .
.
Из уравнения Пуассона следует, что переход газа из I состояния во П может быть выражен в виде:

откуда
 (6)
(6)
Охладившийся при расширении воздух в баллоне через некоторое время вследствие теплообмена нагреется до температуры внешней среды T1, давление возрастёт до некоторой величины р + р2, где р2 — новая разность уровней в манометре. Об]ём воздуха не изменится и будет равен V2. Это состояние назовём III. Переход газа из II состояния в III происходит в условиях постоянного объёма — изохорно. III состояние характеризуется параметрами р + р2; V2 и T1. Так как в I и III состояниях воздух имеет одну и ту же температуру (процесс изотермический), то, применяя закон Бойля-Мариотта, будем иметь:

откуда получим
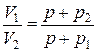 (7)
(7)
Возведя обе части уравнения в степень g, получим
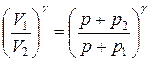 (8)
(8)
Пользуясь выражением (6) и приравняв правые части (8) и (6), получим
 (9)
(9)
Прологарифмируем выражение (9) и, решая относительно g, получим:
 (10)
(10)
Так как практически давление р, р+р1 и р+р2 отличаются друг от друга незначительно, то в формуле (10) разности логарифмов можно принять пропорциональными разностям самих давлений и приближенно положить
 (11)
(11)
Порядок выполнения работы
1. Открыть кран К1 и при закрытом кране К2 накачать осторожно с помощью насоса в баллон воздух так, чтобы разность уровней жидкости в манометре составила 25—35 см.
2. Закрыть кран К1 и, выждав несколько минут, пока уровни жидкости в манометре перестанут изменятся (это означает, что температура воздуха в баллоне сравняется с температурой окружающей среды) отсчитать по шкале разность уровней р1 в левой и правой трубках манометра.
3. З. Открыть кран К2 и, прислушавшись к шипению воздуха, быстро закрыть его по прекращении шипения, что соответствует выравниванию давления внутри баллона с атмосферным. Уровень жидкости в манометре будет изменяться, так как исследуемый воздух, охлажденный при адиабатном процессе расширения, нагреется до температуры окружающей среды. Выждав некоторое время, когда разность уровней жидкости в манометре станет устойчивой, отсчитать в миллиметрах эту разность р2.
4. Открыть оба крана К1 и К2 на 2—3 минуты.
5. Пересчитать показания давления р1 и р2 из миллиметров водяного столба в паскали, принимая, Что 1 миллиметр водяного столба равен 9,81 паскаля.
6. Проделав опыт один раз, вычислить по формуле (11) значение g и сравнить с g, вычисленным теоретически по (4). Если между ними окажется большое расхождение, то опыт проведён невнимательно с нарушением методики, а поэтому его повторить вновь, добиваясь хорошего совпадения опытного и теоретического значения g.
7. Опыт повторяют 5-7 раз. Результаты измерений заносят в таблицу.
8. Подставляя в формулу (11) значения р1 и р2, взятые из каждого отдельного опыта, вычисляют g1, g2, g3 и т.д. Из найденных значений g найти среднее значение.
Таблица наблюдений
| № опыта | p1 | p2 | g | < g> |
| Единицы измерения | Па | Па | – | – |
Контрольные вопросы
1. Какие теплоемкости различают для газов в зависимости от условий нагревания?
2. Что называется удельной, молекулярной теплоемкостью при постоянном объеме, постоянном давлении?
3. Почему Ср больше, чем Сv?
4. Какой процесс называется адиабатным, изотермическим, изохорным?
5. Что происходит с внутренней энергией газа при адиабатном процессе?
6. Как изменяется температура газа при адиабатном процессе?
7. Вывести формулу (11)
8. Выразить Ср и Сv через число степеней свободы молекул газа?
9. Рассчитать теоретически g для различных газов (Н2, Не, СО2).






