МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Уфимский государственный нефтяной технический университет
Филиал в г. Салавате
Кафедра «Химико-технологических процессов»
ОТЧЁТ
по лабораторной работе по физической химии
Определение порядка реакции окисления йодид-ионов ионами
Трёхвалентного железа
ХТП-ФХ-3-04.00.00.000 ЛР
Выполнил:
Студент гр. ТП-01-21 Д.Х. Файрузов
Проверил:
Ассистент А.В. Ситдикова
Салават 2003 г.
Цель работы: установление частных порядков и общего порядка реакции
 . (1)
. (1)
Краткие теоретические основы: Для определения частных порядков по отношению к Fe3+ и J- используется дифференциальный метод Вант-Гоффа. Допускают, что начальная скорость реакции определяется уравнением
 , (2)
, (2)
где  - начальная концентрация Fe3+;
- начальная концентрация Fe3+;
 - начальная концентрация J-;
- начальная концентрация J-;
n1,n2 – частные порядки.
После логарифмирования уравнения (2) получим
 . (3)
. (3)
Если в серии опытов изменяют начальную концентрацию ионов трехвалентного железа, а начальную концентрацию ионов йода сохраняют постоянной, то уравнение (3) можно записать в виде
 , (4)
, (4)
где А2 – постоянная величина, равная  .
.
Если же в серии опытов изменяют начальную концентрацию йода, а концентрацию трехвалентного железа сохраняют постоянной, то уравнение (4) можно преобразовать в вид
 , (5)
, (5)
где А2 – постоянная величина, равная  .
.
Уравнения (4) и (5) используются для определения порядков по отношению к ионам трехвалентного железа и ионам йода.
Порядок проведения эксперимента.
Определение частного порядка по отношению к Fe3+: В четыре колбы наливают растворы Fe(NO3)3, HNO3, KNO3 и дистиллированную воду в тех соотношениях, которые указаны в таблице 1.
| Раствор | Объём раствора, мл | |||
| Колба 1 | Колба 2 | Колба 3 | Колба4 | |
| 1/60МFe(NO3)3 | ||||
| 0,1M HNO3 | ||||
| 0,1M KNO3 | ||||
| H2O |
Таблица 1 - Объемы растворов, необходимые для эксперимента
В первую колбу добавляют несколько капель 1 % (масс.) раствора крахмала, 20 мл 0,025М KJ, раствор энергично перемешивают. Момент вливания раствора KJиз пипетки в колбу принимают за начало реакции (включают секундомер и не выключают его, пока не проделают опыт с одной колбой). Выделившийся йод в результате протекания реакции взаимодействует с крахмалом, и реакционная смесь окрашивается в синий цвет. Через 2 минуты после начала реакции в реакционную смесь вливают 0,01 М Na2S2O3до исчезновения синей окраски. Отмечают на бюретке количество добавленного раствора тиосульфата и время повторного появления синей окраски. Через 2 минуты снова добавляют раствор тиосульфата до исчезновения синей окраски. Эту операцию проделывают 5-6 раз.
Аналогичные опыты проделывают со второй, третьей и четвертой колбами. Экспериментальные данные заносят в таблицу.
Обработка экспериментальных данных: В момент появления синей окраски количество добавленного тиосульфата эквивалентно количеству двухвалентного железа:
 , (6)
, (6)
где Сm– концентрация тиосульфата;
Сx– концентрация двухвалентного железа;
Vm– общий объем израсходованного тиосульфата от начала реакции к
моменту времени t;
V– объем реакционной смеси, принимаем равным 100 мл.
Из уравнения (6) следует:
 . (7)
. (7)
Результаты заносят в таблицу.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 1,8 | 0,00018 | 5555,55 | 0,005 | |
| 3,9 | 0,00039 | 2564,102 | 0,00212 | |
| 6,4 | 0,00064 | 1562,5 | 0,00153 | |
| 9,3 | 0,00093 | 1075,28 | 0,00121 | |
| 12,6 | 0,00126 | 793,65 | 0,00101 |
Таблица 2 - Результаты кинетических измерений колбы 1.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 2,2 | 0,00022 | 4545,45 | 0,00571 | |
| 5,2 | 0,00052 | 1923,02 | 0,0027 | |
| 8,7 | 0,00087 | 1149,42 | 0,0018 | |
| 12,6 | 0,00126 | 793,65 | 0,00139 | |
| 17,1 | 0,00171 | 584,79 | 0,00102 |
Таблица 3 - Результаты кинетических измерений колбы 2.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 0,00030 | 3333,33 | 0,0055 | ||
| 6,8 | 0,00068 | 1470,58 | 0,0026 | |
| 11,3 | 0,00113 | 884,95 | 0,00178 | |
| 16,8 | 0,00168 | 595,28 | 0,00132 | |
| 22,6 | 0,00226 | 442,47 | 0,00104 |
Таблица 4 - Результаты кинетических измерений колбы 3.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 0,0004 | 0,0052 | |||
| 9,5 | 0,00095 | 1052,63 | 0,00281 | |
| 15,6 | 0,00156 | 641,52 | 0,002 | |
| 22,5 | 0,00225 | 444,41 | 0,00151 | |
| 30,2 | 0,00302 | 331,12 | 0,0011 |
Таблица 5 - Результаты кинетических измерений колбы 4.
Для нахождения скорости реакции в начальный момент времени используется эмпирическое уравнение
 , (8)
, (8)
где α и β – постоянные величины.
Воспользовавшись уравнением (8), легко показать, что
 . (9)
. (9)
Величина β определяется из тангенса угла наклона прямой в координатах 1/τ = f (1/Сх). Величина β может быть так же рассчитана по способу наименьших квадратов.

Рисунок 1 -  для определения по отношению к Fe3+
для определения по отношению к Fe3+
Вычислим значение величины β.
 (10)
(10)
Подставляя числовые значения для первой колбы, получим


Подставляя числовые значения для второй колбы, получим


Подставляя числовые значения для третьей колбы, получим


Подставляя числовые значения для четвёртой колбы, получим

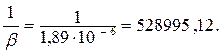
Вычисленные значения 1/β заносят в таблицу 6.
| № колбы | ||||
 моль/л моль/л
| 1,67 | 3,34 | 5,01 | 6,68 |
| 1/β | 1193458,64 | 844490,4 | 648174,88 | 528995,12 |

| -2,77 | -2,47 | -2,30 | -2,17 |
| lg1/β | 6,07 | 5,92 | 5,81 | 5,72 |
Таблица 6 - Зависимость 1/β от 
На основании полученных значений [dCx/dτ] = 1/ β в четырех опытах строят график в осях координат  = f(lg(l/β)).
= f(lg(l/β)).
Согласно уравнению (3) тангенс угла наклона прямой будет равен частному порядку по отношению к железу.
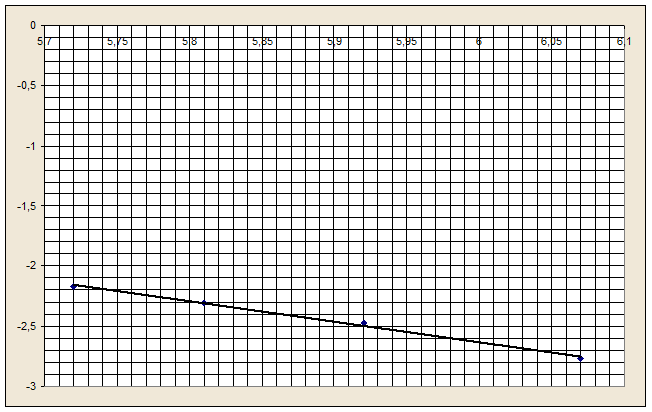
Рисунок 2 - 
Вычислим частный порядок по отношению к железу.
 (11)
(11)
Подставляя числовые значения, получим

Частный порядок по отношению к Fe3+ равен 2.
Определение частного порядка по отношению к I-: В четыре колбы наливают растворы KJ, HNO3, KNO3и дистиллированную воду в тех соотношениях, которые указаны в таблице 7.
| Раствор | Объём раствора, мл | |||
| Колба 1 | Колба 2 | Колба 3 | Колба4 | |
| 0,025 М KJ | ||||
| 0,1M HNO3 | ||||
| 0,1M KNO3 | 32,5 | 27,5 | ||
| H2O | 27,5 | 12,5 |
Таблица 7 - 0бъемы растворов, необходимые для эксперимента
В первую колбу добавляют несколько капель 1 % (масс.) раствора крахмала, 20 мл 1/60 М Fe(NОз)з. Отмечают время начала реакции. В дальнейшем методика работы аналогична работе по определению порядка реакции по отношению к ионам Fe3+.
Опытные и расчетные данные заносят в таблицы, аналогичные таблицам при определении порядка реакции по отношению к Fe3+.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 0,0002 | 0,008 | |||
| 4,3 | 0,00043 | 2325,58 | 0,00377 | |
| 5,5 | 0,00055 | 1818,18 | 0,0025 | |
| 6,3 | 0,00063 | 1587,3 | 0,001869 | |
| 7,4 | 0,00074 | 1351,35 | 0,00149 |
Таблица 8 - Результаты кинетических измерений колбы 1.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 0,0007 | 1428,57 | 0,00769 | ||
| 9,7 | 0,00097 | 1030,927 | 0,00377 | |
| 11,6 | 0,00116 | 862,068 | 0,00246 | |
| 13,2 | 0,00132 | 757,27 | 0,00181 | |
| 14,3 | 0,00143 | 699,3 | 0,00142 |
Таблица 9 - Результаты кинетических измерений колбы 2.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 10,2 | 0,00102 | 980,392 | 0,00689 | |
| 13,4 | 0,00134 | 746,26 | 0,00338 | |
| 15,5 | 0,00155 | 645,16 | 0,0022 | |
| 17,3 | 0,00173 | 578,03 | 0,00163 | |
| 18,8 | 0,00188 | 531,916 | 0,00129 |
Таблица 10 - Результаты кинетических измерений колбы 3.
| τ, сек | Vm,мл | Сх, моль/л | 1/Сх | 1/τ |
| 0,0014 | 714,28 | 0,00625 | ||
| 19,5 | 0,00195 | 512,82 | 0,00243 | |
| 0,0021 | 476,19 | 0,00175 | ||
| 22,5 | 0,00225 | 444,44 | 0,00136 | |
| 23,7 | 0,00237 | 421,94 | 0,00109 |
Таблица 11 - Результаты кинетических измерений колбы 4.

Рисунок 3 -  для определения по отношению к I-
для определения по отношению к I-
Вычислим значение величины β.

Подставляя числовые значения для первой колбы, получим

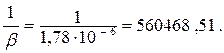
Подставляя числовые значения для второй колбы, получим


Подставляя числовые значения для третьей колбы, получим


Подставляя числовые значения для четвёртой колбы, получим
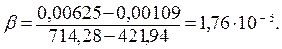

Вычисленные значения 1/β заносят в таблицу 12.
| № колбы | ||||
  моль/л моль/л
| 2,5 | 5,0 | 7,5 | 10,0 |
| 1/β | 560468,51 | 80085,357 | 56655,03 | |

| -2,6 | -2,3 | -2,12 | -2 |
| lg1/β | 5,748 | 5,065 | 4,903 | 4,753 |
Таблица 12 - Зависимость 1/β от 
Порядок реакции по отношению к J- находят из графика  = f(
= f( ). Согласно уравнению (5) тангенс угла наклона прямой будет равен частному порядку по отношению к йоду.
). Согласно уравнению (5) тангенс угла наклона прямой будет равен частному порядку по отношению к йоду.

Рисунок 4 - 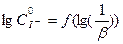
Вычислим частный порядок по отношению к йоду.
 (12)
(12)
Подставляя числовые значения, получим
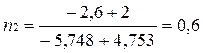
Частный порядок по отношению к I-равен 1.
Общий порядок реакции равен сумме частных порядков по отношению к Fe3+и J-.
 . (13)
. (13)
Подставляя числовые значения, получим
n=2+1=3.
Вывод:
Общий порядок реакции мы определили как сумма частных порядков реакций по отношению к Fe3+ и I-; общий порядок равен 3.






