ПРАКТИЧЕСКАЯ РАБОТА
Тема: «Свойства оксидов»
Цель: изучить на практике реакции, характеризующие свойства оксидов металлов и оксидов неметаллов
Теоретическая часть
Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых кислород.
Al2O3 − оксид алюминия
BaO − оксид бария
Li2O − оксид лития
MgO − оксид магния.
Большинство оксидов − твердые вещества, но могут быть жидкими и газообразными веществами. Оксиды не диссоциируют на ионы.
Название оксида состоит из слов «оксид» + название элемента + валентность элемента римскими цифрами:
N2O − оксид азота (I).
Если оксид имеет постоянную валентность, ее в названии оксида не указывают:
А12О3 − оксид алюминия.
Название оксидов можно также образовывать добавлением к слову «оксид» греческих числительных.
СО2 − диоксид углерода
SО2 − диоксид серы
SO3 − триоксид серы
OsO4 − тетраоксид осмия.
Оксиды подразделяются на две группы: несолеобразующие и солеобразующие. Каждую группу, в свою очередь, подразделяют на несколько подгрупп.
Несолеобразующие оксиды не имеют своих гидроксидов и не вступают в реакции обмена. К несолеобразующим оксидам принадлежат безразличные (индифферентные) оксиды:
CO − оксид углерода (II)
N2O − оксид азота (I)
NO − оксид азота (II)
SiO − оксид кремния (II)
Группа солеобразующих оксидов включает в себя основные, кислотные и амфотерные оксиды.
К основным оксидам относятся только оксиды металлов: щелочных (Li, Na, К, Rb, Cs, Fr), щелочноземельных (Ca, Sr, Ba, Ra), магния, лантана, а также всех остальных металлов в их низших степенях окисления.
N2O, CaO, Cu2O, CrO, MnO, BaO La2O3 − основные оксиды.
Им соответствуют основания
| Оксид | Соответствующее оксиду основание | ||
| формула | название | формула | название |
| Na2O | Оксид натрия | NaOH | Гидроксид натрия |
| MgO | Оксид магния | Mg(OH)2 | Гидроксид магния |
| CaO | Оксид кальция | Ca(OH)2 | Гидроксид кальция |
В подгруппу кислотных оксидов входят, прежде всего, оксиды неметаллов, а также оксиды переходных металлов в высоких степенях окисления.
Р2О5 − оксид фосфора (V) (фосфорный ангидрид)
SO2 − оксид серы (IV) (сернистый газ)
СrО3 − оксид хрома (VI) (триоксид хрома)
SiO2 − оксид кремния (кварцевый песок).
Этим оксидам соответствуют кислоты
| Оксид | Соответствующая оксиду кислота | ||
| формула | название | формула | название |
| SO2 | оксид серы (IV), сернистый ангидрид | H2SO3 | сернистая кислота |
| SO3 | оксид серы (VI), сернистый ангидрид | H2SO4 | серная кислота |
| P2O5 | оксид фосфора, (V) фосфорный ангидрид | H3PO4 | фосфорная кислота |
Кислотные оксиды, образованные металлами, при обычных условиях − твердые вещества, а образованные неметаллами − не только твердые, но и жидкие, и газообразные.
Амфотерные оксиды обладают двойственной природой, и им соответствуют гидроксиды, проявляющие свойства как оснований, так и свойства кислот. Амфотерные оксиды образованы амфотерными металлами, которые находятся в периодической системе химических элементов Д. И. Менделеева либо в главных подгруппах вблизи диагонали «бор – астат», либо в побочных подгруппах.
А12О3 − оксид алюминия
Сr2О3 − оксид хрома (III)
ZnO − оксид цинка
ВеО − оксид бериллия
CuO − оксид меди (II)
Fе2О3 − оксид железа (III
Амфотерными называются оксиды, которые образуют как кислоты, так и основания:

Все амфотерные оксиды − твердые вещества.
Таким образом, неметаллы образуют только кислотные оксиды; металлы образуют все основные оксиды, все амфотерные и некоторые кислотные оксиды.
Основные способы получения оксидов
1. Окисление простых веществ кислородом:

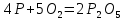
Этот метод практически неприменим в случае щелочных и щелочноземельных металлов, которые при окислении дают, как правило, пероксиды:
 .
.
2. Обжиг сульфидов:
 ↑
↑
 ↑
↑
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов:

3. Термическое разложение (пиролиз) слабых оснований:


Метод неприменим для получения оксидов металлов, образующих сильные основания, поскольку щелочи практически не подвержены пиролизу.
4. Термическое разложение (пиролиз) солей кислородсодержащих кислот:
 ↑
↑

Термическому разложению подвергаются главным образом соли тяжелых металлов, выделяющие в качестве одного из продуктов реакции какое-либо летучее соединение.
5. Взаимодействие металла с другим оксидом:

Практическая часть
Свойства основных оксидов
Оборудование и реактивы: пробирки, ложечка для веществ, оксид кальция, вода,индикатор, оксид меди, соляная кислота.
Ход работы:
а) В пробирку поместите небольшое количество оксида кальция, добавьте 1-2 мл воды. Перемешайте полученный раствор и добавьте 1-2 капли индикатора фенолфталеин.
Отметьте изменение окраски.
Запишите уравнение реакции
б) В пробирку поместите небольшое количество оксида меди (со спичечную головку) и добавьте 2-3 мл соляной кислоты
Отметьте признак реакции
Запишите уравнение реакции
Запишите краткое ионное уравнение






