100 г раствора содержат 15 г Н2SO4
110 г раствора» х г Н2SO4,
х =16,5 г Н2SO4
или m  = 110×
= 110× 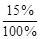 = 16,5 г.
= 16,5 г.
Далее найдем массу 96 %-ного (по массе) раствора Н2SO4, в котором содержится 16,5 г Н2SO4,
в 100 г раствора содержится 96 г Н2SO4
х г»» 16,5 г Н2SO4;
х = 17,2 г раствора или m 96%-ного р-ра = 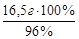 = 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
= 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
 ; V = 17,2/1,84 = 9,34 мл.
; V = 17,2/1,84 = 9,34 мл.
Итак, для приготовления 100 мл 15%-ного раствора Н2SO4 потребуется 9,34 мл 96%-ного раствора и 110 г - 16,5 г = 93,5 г Н2О.
Задача 3. Определите молярную концентрацию раствора NaOH, если в 200 мл раствора содержится 1,6 г растворенного вещества.
Решение. Молярная масса NaOH равна 40 г/моль. Определим количество молей NaOH, содержащихся в 200 мл раствора:
n =  = 1,6: 40 = 0,04 моля.
= 1,6: 40 = 0,04 моля.
Исходя из определения молярной концентрации, найдем количество молей NaOH, содержащихся в 1 л раствора:
СM = n / V
СM = 0,04: 0,2 = 0,2 моль/л.
Задача 4. Какова нормальность раствора хлорида железа (III), в 0,3 л которого содержится 32,44 г соли?
Решение. Молярная масса хлорида железа равна 162,5 г/моль. Эквивалентная масса FeCl3 = 162,5: 3 = 54,17 г/моль-экв.
Определим количество моль-эквивалентов растворенного вещества (FeCl3), содержащихся в 0,3 л раствора:
n = 32,44: 54,17 = 0,6 моль-эквивалентов (эквивалентов).
Нормальность определяется количеством моль-эквивалентов растворенного вещества в 1 л раствора. Следовательно, 0,3 л содержит 0,6 моль-эквивалента
1 л» х моль-эквивалентов;
х = 2 моль-эквивалента (эквивалента).
С Н = 2 (2н раствор) или С Н =  экв./л.
экв./л.
Задача 5. Определите молярность, нормальность и титр 15%-ного раствора серной кислоты. Плотность раствора r =1,10 г/см3.
Решение. 1. Примем объем раствора, равным 1 л. Определяем массу (г) серной кислоты, содержащуюся в 1 л ее раствора, из пропорции
в 100 г раствора содержится 15 г Н2SO4
в 1,10 × 1000 г»» х г Н2SO4,
отсюда следует, что в 1л раствора массой 1,10 × 1000 г содержится х =165 г Н2SO4;
2. Молярная масса Н2SO4 равна 98 г/моль, в 1л раствора содержится Н2SO4 165: 98 = 1,68 моль. Таким образом С М = 1,68 моль/л;
3. Эквивалент Н2SO4 равен 98: 2 = 49 г/моль-экв. или 49 г/экв. Количество моль-эквивалентов в165 г Н2SO4 равно 165: 49 = 3,36 моль-эквивалентов. Следовательно, в 1л раствора содержится 3,36 моль-эквивалентов
С Н = 3,36 моль-экв./л (экв./л);
4. Определим титр раствора. Т = m / V; Т = 165: 1000 = 0,165 г/мл.
Задача 6. В каком объеме 0,5 нормального раствора карбоната натрия содержится 10 г соли? Какова молярность и титр этого раствора?
Решение. 1. Исходя из определения нормальности, в 1 литре раствора содержится 0,5 моль-эквивалентов Na2CO3.
Эквивалентная масса Na2CO3 = 106: 2 = 53 г/моль-экв. Следовательно, в 1 л 0,5 н раствора содержится 0,5 × 53 = 26,5 г Na2CO3,
тогда в 1л 0,5н раствора содержится 26,5 г Na2CO3
в х л» 10 г Na2CO3
х = 0,38 л;
2. Определим С М раствора. В 1 л 0,5н раствора содержится 26,5 г Na2CO3. Находим количество молей Na2CO3
n = 26,5:106=0,25 молей, следовательно, С М = 0,25 моль/л.
3. Определим титр раствора.
В 1000 мл раствора содержится 26,5 г Na2CO3
в 1мл раствора» х г
х = 0,0265 г, Т = 0,0265 г/мл.
Задача 7. Для нейтрализации 42 мл серной кислоты потребовалось 14 мл 0,3 н раствора щелочи. Определите молярность раствора Н2SO4.
Решение. Поскольку вещества реагируют между собой в эквивалентных количествах (закон эквивалентов), то можно написать
C Н кислоты× V кислоты = C Н щелочи× V щелочи
Следовательно, C Н кислоты × 42 = 14 × 0,3; C Н кислоты = 0,1.
C Н кислоты = 0,1 моль-эквивалентов/л. Молярная масса Н2SO4 = 98 г/моль; эквивалентная масса Н2SO4 =98: 2 = 49 г/моль-экв., или эквивалентная масса составляет 0,5 моля Н2SO4.
Отсюда молярность раствора Н2SO4 составит 0,1 × 0,5 = 0,05 моль/л, C М = 0,05 моль/л.
Или примем Vх раствора = 1 л, тогда m 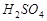 = C Н × Э × V;
= C Н × Э × V;
 = 0,1×49×1 = 4,9 г; C М =
= 0,1×49×1 = 4,9 г; C М = 
 = 0,05 моль/л.
= 0,05 моль/л.






