Лабораторная работа № 6.2
ИЗУЧЕНИЕ СПЕКТРОВ
Цель работы
1. Изучить спектр испускания атомов ртути.
2. Выполнить градуировку спектроскопа.
3. Определить интервалы длин волн соответствующих разным цветам сплошного спектра лампы накаливания.
Краткая теория
Оптические свойства атомов определяются состоянием валентных электронов. Согласно современным представлениям, электроны в атомах могут находиться лишь в некоторых состояниях, которым соответствуют строго определенные дискретные значения энергии, называемые энергетическими уровнями.
В простейшем случае, в атоме водорода имеется один единственный электрон, который является валентным электроном. Значения энергии для электрона в атоме водорода определяются формулой:
 (1)
(1)
Здесь первая дробь представляет собой набор констант, а  - главное квантовое число. Обозначим:
- главное квантовое число. Обозначим:
 (2)
(2)
Тогда
 (3)
(3)
Здесь  - энергия основного состояния электрона в атоме водорода. Полезно запомнить, что
- энергия основного состояния электрона в атоме водорода. Полезно запомнить, что  = 13,6 эВ. Поэтому формулу (3)часто пишут в виде:
= 13,6 эВ. Поэтому формулу (3)часто пишут в виде:
 эВ (4)
эВ (4)
Энергетическая диаграмма атома водорода приведена на рисунок 2.1.
В случае внешних воздействий атом, т.е. фактически его электрон, может получить дополнительную энергию и перейти в одно из возбужденных состояний, энергия которых больше, чем энергия основного состояния. Такие переходы называют переходами на более высокие энергетические уровни. Из возбужденных состояний атом спонтанно, т.е. самопроизвольно, переходит в основное состояние или на один из более низких энергетических уровней, рисунок 2.2. При этом атом излучает в окружающее пространство энергию:
 (5)
(5)
Здесь  - энергия атома в исходном состоянии, а
- энергия атома в исходном состоянии, а  - энергия атома в конечном состоянии. Энергия
- энергия атома в конечном состоянии. Энергия  излучается в виде кванта электромагнитного излучения
излучается в виде кванта электромагнитного излучения  , так что
, так что
 (6)
(6)
 |
Соотношение (6) часто называют правилом частот Бора.
Из соотношений (1) и (6) следует, что частота излучения равна:
 (7)
(7)
Выразив циклическую частоту  через длину волны
через длину волны  , можно записать, что
, можно записать, что
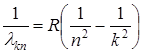 (8)
(8)
Здесь величина  = 1,0967758 107 м-1 называется постоянной Ридберга.
= 1,0967758 107 м-1 называется постоянной Ридберга.
 (9)
(9)
Совокупность длин волн (или частот), излучаемых телом, называют спектром излучения этого тела. Как мы видим, вследствие квантования энергетических уровней электронов в атомах, атомарные спектры излучения состоят из дискретного набора длин волн (частот). Такие спектры называются линейчатыми.
Совокупность спектральных линий, т.е. длин волн или частот, соответствующих переходам на один и тот же энергетический уровень образует серию линий. Так, например, совокупность переходов в основное состояние ( = 1) образует серию Лаймана, совокупность переходов в состояние с
= 1) образует серию Лаймана, совокупность переходов в состояние с  = 2, образует серию Бальмера, переходы в состояние с
= 2, образует серию Бальмера, переходы в состояние с  = 3, образуют серию Пашена и так далее. Видимый участок в спектре водорода целиком сосредоточен в серии Бальмера и представлен четырьмя первыми линиями в этой серии. Частоты и длины волн этих линий могут быть рассчитаны по формулам (7) - (9).
= 3, образуют серию Пашена и так далее. Видимый участок в спектре водорода целиком сосредоточен в серии Бальмера и представлен четырьмя первыми линиями в этой серии. Частоты и длины волн этих линий могут быть рассчитаны по формулам (7) - (9).
 |
В атоме водорода энергия валентного электрона определяется значением главного квантового числа и не зависит от значений других квантовых чисел. В более сложных атомах снимается вырождение энергии по другим квантовым числам. Это значит, что энергия электронов в атоме зависит не только от значений главного квантового числа, но также зависит от значений орбитального, магнитного и спинового квантовых чисел. Поэтому энергетические диаграммы всех атомов становятся более сложными по сравнению с диаграммой атома водорода. Как правило, влияние магнитного и спинового квантовых чисел на энергию электрона в атоме незначительно, поэтому часто на энергетических диаграммах не отражается. Влияние орбитального квантового числа является существенным.
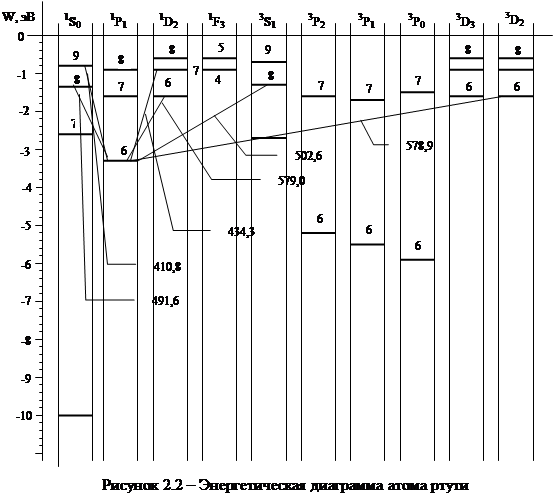
На рисунке 2.2 приведена часть энергетических уровней атома ртути с учетом спин-орбитального взаимодействия и некоторые переходы, соответствующие видимой области спектра излучения. Значения главных квантовых чисел проставлены над энергетическими уровнями. Другие квантовые числа зашифрованы при помощи букв S,P,D,F, обозначающих различные электронные состояния. Из диаграммы видно, что при одном и том же значении главного квантового числа, например  = 6, может существовать несколько электронных состояний с различными значениями других квантовых чисел. Этим состояниям соответствуют разные энергетические уровни.
= 6, может существовать несколько электронных состояний с различными значениями других квантовых чисел. Этим состояниям соответствуют разные энергетические уровни.
Так же, как и в атоме водорода, при переходе электронов из состояний с большей энергией в состояние с меньшей энергией, излучается квант света, длина волны которого может быть вычислена при помощи правила частот (6).
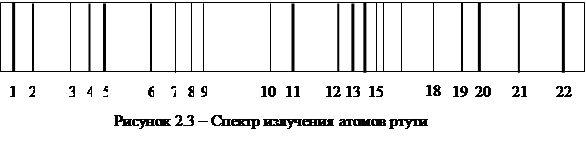 |
Спектр излучения ртути хорошо изучен, и потому часто используется для градуировки спектральных приборов. На рисунке 2.3 приведены основные линии спектра излучения ртути, а в таблице даны соответствующие им длины волн.
Таблица 1 - Характеристики линий в спектре излучения атомов ртути
| № линии | ||||||
| l, нм | 404,7 | 433,9 | 434,7 | 435,8 | 491,6 | 502,6 |
| цвет | фиолетовый | синий | синий | синий | бирюзовый | бирюзовый |
| № линии | ||||||
| l, нм | 546,1 | 577,0 | 580,4 | 607,3 | 623,4 | |
| цвет | Зеленый | желтый | желтый | красный | красный |
Описание установки
Схема лабораторной установки показана на рисунке 2.4. Установка состоит из источника света - лампы(3), закреплённой на штативе (2), и спектроскопа(4)-(6).
 |
Лампа включается в сеть при помощи пускового устройства (1).
Спектроскоп - устройство, позволяющее разлагать электромагнитное излучение в спектр, т.е. выделять кванты с одной энергией и фиксировать их визуально. Оптическая схема прибора приведена на рисунке 2.5.
 |
Свет от источника (1) проходит через щель (2) и с помощью системы линз (3) и зеркал (4),(8) проецируется на вогнутую дифракционную решетку (9), равномерно заполняя её. Дифракционная решетка играет роль фокусирующего и диспергирующего элемента. Полученный спектр при помощи зеркал (7) и (5) направляется в окуляр (6), через который он и наблюдается исследователем.
Спектр испускания атомов ртути имеет вид цветных линий на темном фоне.
Задание и методические указания
Задание 1. Градуировка спектроскопа
ВНИМАНИЕ! В работе применяется ртутная лампа, являющаяся мощным источником ультрафиолетового излучения. Запрещается смотреть непосредственно на ртутную лампу, т.к. при прямом попадании света в глаза возможен ожег сетчатки глаза.
Градуировкой измерительного прибора называется операция, при помощи которой шкала измерительного пробора приводится в соответствие с измеряемой величиной. Результаты градуировки представляются в виде графиков, таблиц или в виде новой шкалы.
В нашей работе необходимо установить соответствие между числом делений шкалы (6) микровинта спектроскопа, рисунок 2.4, и длинами волн линий, совмещаемых с визиром спектроскопа. Результаты градуировки должны быть оформлены в виде градуировочного графика.
Градуировка спектроскопа выполняется по спектру ртутной лампы, представленному на рисунке 2.3 и в таблице 1.
Рекомендуется следующий порядок выполнения задания.
1. Установить выходное окно лампы против входного окна спектроскопа.
2. Включить пусковое устройство (1), рисунок 2.4. Нажать кнопку "пуск" на пусковом устройстве и удерживать ее в нажатом состоянии до зажигания ртутной лампы, примерно 5-10 с. После этого кнопку "пуск" следует отпустить. Прогреть лампу в течение 10 мин.
3. Наблюдать спектр в окуляр (5) и перемещением ртутной лампы (3) установить максимальную яркость линий.
4. Наблюдая в окуляр (5), рисунок 2.4, и, вращая микровинт (6),просмотреть весь спектр и сопоставить его со спектром, приведенным на рисунке 2.3.
5. Отыскать в спектре линии, для которых даны длины волн в таблице 1, поочередно совместить их с визиром спектроскопа в окуляре (5) и зафиксировать соответствующие им показания n шкалы микровинта (6) в таблице результатов.
6. Построить график зависимости  от
от  . График должен представлять монотонную линию.
. График должен представлять монотонную линию.
Задание 2. Изучение сплошного спектра
Во втором задании мы познакомимся со сплошным спектром лампы накаливания. Работу выполняйте в описанном ниже порядке.
1. Выключите ртутную лампу и осторожно передвиньте ее в сторону.
Будьте внимательны! Кожух ртутной лампы во время работы сильно нагревается.
2. Установите выходное окно лампы накаливания напротив входного окна спектроскопа и включите лампу накаливания.
3. Перемещая лампу накаливания, добейтесь максимальной яркости спектра.
4. Просмотрите весь спектр и выделите в нем различные цвета - красный, оранжевый и так далее.
5. Определите граничные длины волн выделенных цветов при помощи построенного вами градуировочного графика.
Контрольные вопросы
1. Поясните строение атома водорода.
2. Поясните энергетическую диаграмму атома водорода.
3. Как объяснить эффект излучения электромагнитных волн атомами вещества?
4. Почему атомарные спектры веществ являются линейчатыми?
5. Как объясняется существование спектральных серий?
6. Что такое квантовые числа? Какова их роль?
7. Поясните принцип работы спектроскопа.
8. В чем состоит градуировка спектроскопа? Для чего она проводится?
Задачи к лабораторной работе
1.1 Определите энергию фотона, испускаемого при переходе электрона в атоме водорода с третьего энергетического уровня на основной.
1.2 Невозбужденный атом водорода поглощает квант излучения с длиной волны 102,6 нм. Вычислите, пользуясь теорией Бора, радиус электронной орбиты возбужденного атома водорода.
1.3 Найдите наименьшую и наибольшую длину волны в ультрафиолетовой серии водорода (серия Лаймана).
1.4 Электрон, имеющий вдали от покоящегося протона скорость 1,875 106 м/с, захватывается последним, в результате чего образуется возбужденный атом водорода. Определите длину волны фотона, который образуется при переходе атома в нормальное состояние.
2.1 Атомарный водород, возбужденный некоторым монохроматическим источником света, испускает только три спектральные линии. Определите квантовое число энергетического уровня, на который переходят возбужденные атомы, а также длины волн испускаемых линий.
2.2 Возбужденный атом водорода при переходе в основное состояние испустил два кванта, последовательно, с длинами волн 40510 А и 972.5 А. Определите энергию первоначального состояния данного атома и соответствующее ему квантовое число.
2.3 Длина волны головной линии серии Лаймана и границы серии Бальмера в спектре атомарного водорода равны 1215 А и 3650 А. Известны, кроме того, значение скорости света и постоянной Планка. Вычислите на основании этих данных энергию ионизации атома водорода.
2.4 Квант света с энергией 15 эВ выбивает фотоэлектрон из атома водорода, находящегося в нормальном состоянии. С какой скоростью будет двигаться электрон вдали от ядра?
3.1 Определите энергию, массу и импульс фотонов, соответствующих красной  и фиолетовой
и фиолетовой  границам волнового спектра.
границам волнового спектра.
3.2 Атом водорода в основном состоянии поглотил квант света с длиной волны 1215  . Определите радиус электронной орбиты возбужденного атома водорода.
. Определите радиус электронной орбиты возбужденного атома водорода.
3.3 Определите наибольшее и наименьшее значение энергии фотона в ультрафиолетовой серии спектра водорода (серии Лаймана).
3.4 Найдите квантовое число, соответствующее возбужденному состоянию однозарядного иона гелия, если при переходе в основное состояние этот ион испустил последовательно два фотона с длинами волн 108,5 нм и 30,4 нм.
4.1 Вычислите длину волны, которую испускает ион гелия  при переходе со второго энергетического уровня на первый.
при переходе со второго энергетического уровня на первый.
4.2 Вычислите частоты обращения электронов в атоме водорода на второй орбите. Сравните с частотой излучения при переходе электрона с третьей орбиты на вторую.
4.3 В каких пределах должны лежать длины волн монохроматического света, чтобы при возбуждении атома водорода квантами этого света наблюдались три спектральные линии?
4.4 Найдите скорость фотоэлектронов, вырываемых электромагнитным излучением с длиной волны 18 нм из однозарядных ионов гелия, которые находятся в основном состоянии и покоятся.
5.1 Насколько изменилась кинетическая энергия в атоме водорода при излучении атомом фотона с длиной волны 486 нм?
5.2 В каких пределах должны лежать длины волн монохроматического света, чтобы при возбуждении атома водорода квантами этого света радиус орбиты электрона увеличился в 9 раз?
5.3 Электрон, пройдя разности потенциалов 4,9 В, сталкивается с атомом ртути и переводит его в возбужденное состояние. Какую длину волны имеет фотон, соответствующий переходу атома ртути в нормальное состояние?
5.4 Энергия связи электрона в основном состоянии атома гелия равна 24,6 эВ. Найдите энергию, необходимую для удаления обоих электронов из этого атома.
6.1 Электрон в невозбужденном атоме водорода получил энергию 12,1 эВ. На какой энергетический уровень он перешёл? Сколько линий спектра могут излучиться при переходе электрона на более низкие энергетические уровни?
6.2 В покоящемся атоме водорода электрон перешёл с пятого энергетического уровня в основное состояние. Какую скорость приобрёл атом за счет испускания фотона? Определите энергию отдачи.
6.3 Исходя из теории Бора, найдите скорость электрона на произвольном энергетическом уровне. Сравните скорость электрона на основном энергетическом уровне со скоростью света.
6.4 Чему равна разность энергии в электрон-вольтах между двумя линиями 0,5896 мкм и 0,589 мкм?
Литература
1. Савельев И.В. Курс общей физики. Том 3. М., "Наука", 1979, §§ 12, 15, 16, 17, 28, 29.
2. Яворский Б.М. и Детлаф А.А. Курс физики. Том 3. М., "Высшая школа", 1972, §§ 13.2, 13.3, 13.4, 13.5, 14.1, 14.2.
 |






