Рестрикционный анализ. Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее.
В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК.
В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.
Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям.
Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
Метод молекулярной гибридизации позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда.
Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК.
Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНК используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы.
2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами.
3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА).
Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
№ 41 Понятие о химиотерапии. История открытия химиопрепаратов.
Химиотерапия — специфическое антимикробное, антипаразитарное лечение при помощи химических веществ. Эти вещества обладают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма.
Основоположником химиотерапии является немецкий химик, лауреат Нобелевской премии П.Эрлих, который установил, что химические вещества, содержащие мышьяк, губительно действуют на спирохеты и трипаносомы, и получил в 1910 г. первый химиотерапевтический препарат — сальварсан (соединение мышьяка, убивающее возбудителя, но безвредное для микроорганизма).
В 1935 г. другой немецкий химик Г.Домагк обнаружил среди анилиновых красителей вещество — пронтозил, или красный стрептоцид, спасавший экспериментальных животных от стрептококковой инфекции, но не действующий на эти бактерии вне организма. За это открытие Г.Домагк был удостоен Нобелевской премии. Позднее было выяснено, что в организме происходит распад пронтозила с образованием сульфаниламида, обладающего антибактериальной активностью как in vivo, так и in vitro.
Механизм действия сульфаниламидов (сульфонамидов) на микроорганизмы был открыт Р.Вудсом, установившим, что сульфаниламиды являются структурными аналогами парааминобензойной кислоты (ПАБК), участвующей в биосинтезе фолиевой кислоты, необходимой для жизнедеятельности бактерий. Бактерии, используя сульфаниламид вместо ПАБК, погибают.
Первый природный антибиотик был открыт в 1929 г. английским бактериологом А.Флемингом. При изучении плесневого гриба Penicillium notatum, препятствующего росту бактериальной культуры, А. Флеминг обнаружил вещество, задерживающее рост бактерий, и назвал его пенициллином. В 1940 г. Г. Флори и Э. Чейн получили очищенный пенициллин. В 1945 г. А Флеминг, Г. Флори и Э. Чейн стали Нобелевскими лауреатами.
В настоящее время имеется огромное количество химиотерапевтических препаратов, которые применяются для лечения заболеваний, вызванных различными микроорганизмами.
№ 42 Антибиотики. Природные и синтетические. История открытия природных антибиотиков. Классификация антибиотиков по химической структуре, механизму, спектру и типу действия. Способы получения.
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований.
За тот период, который прошел со времени открытия П.Эрлиха, было получено более 10 000 различных антибиотиков, поэтому важной проблемой являлась систематизация этих препаратов. В настоящее время существуют различные классификации антибиотиков, однако ни одна из них не является общепринятой.
В основу главной классификации антибиотиков положено их химическое строение.
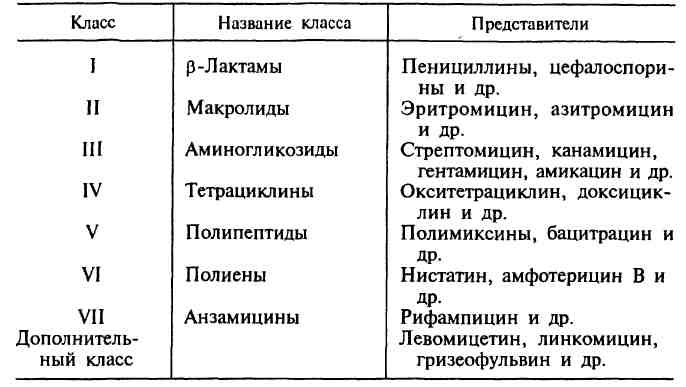
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин).
По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия.
Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии.
В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты.
Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия.
Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов.
Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С.
Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке.
В зависимости от механизма действия различают пять групп антибиотиков:
1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма;
2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены;
3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях;
4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК;
5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды.
Источники антибиотиков.
Основными продуцентами природных антибиотиков являются микроорганизмы, которые, находясь в своей естественной среде (в основном, в почве), синтезируют антибиотики в качестве средства выживания в борьбе за существование. Животные и растительные клетки также могут вырабатывать некоторые вещества с селективным антимикробным действием (например, фитонциды), однако широкого применения в медицине в качестве продуцентов антибиотиков они не получили.
Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали:
• Актиномицеты (особенно стрептомицеты) — ветвящиеся бактерии. Они синтезируют большинство природных антибиотиков (80 %).
• Плесневые грибы — синтезируют природные бета-лактамы (грибы рода Cephalosporium и Penicillium)H фузидиевую кислоту.
• Типичные бактерии — например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием.
Способы получения.
Существует три основных способа получения антибиотиков:
• биологический синтез (так получают природные антибиотики — натуральные продукты ферментации, когда в оптимальных условиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности);
• биосинтез с последующими химическими модификациями (так создают полусинтетические антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например присоединяют определенные радикалы, в результате чего улучшаются противомикробные и фармакологические характеристики препарата;
• химический синтез (так получают синтетические аналоги природных антибиотиков, например хлорамфеникол/левомицетин). Это вещества, которые имеют такую же структуру,
№ 43 Осложнения антибиотикотерапии, их предупреждение.
Как и всякие лекарственные средства, практически каждая группа антимикробных химиопрепаратов может оказывать побочное действие, причем и на макроорганизм, и на микробы, и на другие лекарственные средства.






