1) зависит от активности (концентрации) анализируемых ионов
2) возникает в системе,состо€щей из инертного металла и раствора, содержащего
окислительно-восстановительную систему
3)имеет практически посто€нную величину
4) возникает на границе раздела двух растворов разных электролитов вследствие
различи€ в подвижности их катионов и анионов
7. акое утверждение ошибочно: стекл€нный электрод
1) ионселективный электрод
2)имеет потенциал, который определ€етс€ по формуле: е ст. эл. = ео ст. эл. + 0,059 pH
3)используетс€ дл€ определени€ pH растворов
4) в электрохимической цепи с хлорсеребр€ным электродом расположен справа
8. —текл€нный электрод Ч это:
1)обратимый II рода
2) окислительно-восстановительный
3) ионселективный электрод
4) ферментативный
9. ќкислительно-восстановительный электрод (редокс) Ц это:
1) инертный металл, опущенный в раствор, содержащий окислительно-восстановительную
систему
2) инертный металл (–t), опущенный в раствор его соли
3) любой металл, опущенный в раствор, содержащий окислительно-восстановительную
систему
4) любой металл, опущенный в раствор его соли
10. ¬еличина окислительно-восстановительного потенциала зависит от рЌ дл€ следующей полуреакции:
1) Co+3 +1e- ЂCo+2
2) Fe3+ + 1e-ЂFe2+
3) Cu+2 +1e- ЂCu+
4)‘јƒ+ 2Ќ+ + 2е- Ђ‘јƒЌ2
11. √альванический элемент, в котором протекает реакци€: Fe2+ + Ce4+ = Fe3+ + Ce3+
1) Pt |Ce0 Ce3+ ׀׀ Fe3+ , Fe2+ ׀Pt
2) Pt |Ce4+, Ce3+ ׀׀ Fe3+ , Fe2+ ׀Pt
3)Pt ׀Fe3+, Fe2+׀׀ Ce4+, Ce3+ ׀Pt
4) Pt |Ce4+, Ce3+ ׀׀ Fe0, Fe3+ ׀Pt
12. Ёƒ— концентрационного водородного элемента определ€етс€ по формуле:
1) ≈=0,059(рЌ2- рЌ1)
2) ≈=0,059(рЌ2+рЌ1)
3) ≈= рЌ1-рЌ2
4) ≈=0,059(рЌ1-рЌ2)
13. ƒл€ определени€ рЌ спинно-мозговой жидкости используетс€ индикаторный электрод:
1) стекл€нный - 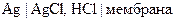
2) редокс-PtúCo,+3Co+2
3) серебр€ный- AgúAg+
4) никелевый-Niú Ni+2
14. акое утверждение ошибочно: при потенциометрическом определении рЌ составл€етс€ электрохимическа€ цепь:
1) стекл€нно-хлорсеребр€на€
2) водородо-ртутнокаломельна€
3) медно-цинкова€
4) водородо-водородна€
15. ≈сли два раствора хлорида кали€ разделить катионообменной мембраной, то на границе раздела возникает:
1) диффузионный потенциал
2 ) окислительно-восстановительный потенциал
3)мембранный потенциал
4) электродный потенциал
16. ѕродукты коррозии оцинкованного железа в растворе сол€ной кислоты:
1) FeO,Fe(OH)2
2) ZnCl2, H2
3) ZnO, Zn(OH)2
4 ) FeCl2,H2
17. ѕри электрохимической коррозии в месте контакта Pd c Ag в протезах, изготовленных из сплава этих металлов, в слабокислой слюне, содержащей растворенный кислород:
1)происходит процесс кислородной депол€ризации: ќ2 + 4Ќ+ + 2е-= 2Ќ2ќ
2 ) происходит процесс водородной депол€ризации: 2Ќ+ + 2е-= Ќ2
3) Pd- выполн€ет роль анода (раствор€етс€, разрушаетс€)
|
|
|
4)Ag- выполн€ет роль катода
- ѕри электролизе раствора CaBr2 на аноде идет процесс окислени€:
1) CaBr2 - 2e-Ѓ Ca+2 + Br2
2) Ca+2 + 2e-Ѓ Ca 0
3) 2Br- - 2e-Ѓ Br2
4) 2H2O + O2 + 4e-Ѓ 4OH-
| ¬ариант 2 | ||||||||||||||||||
„асть ¬
| B-1 | а) —оставить электрохимическую схему из двух стандартных электродов: медного (e0 = 0,340 B) и серебр€ного (e0 = 0,799 ¬); б) Ќаписать уравнени€ реакций, протекающих на электродах и в цепи; в) ¬ычислить Ёƒ— цепи. |
| B-2 | а) ќпределить направление окислительно-восстановительной реакции 2NaBr + S ↔ Na2S + Br2, если e0(Br2, 2Br-) = 1,065 B, e0(S, S2-) = - 0,480 B: б) —оставить гальванический элемент, в котором протекала бы эта реакци€. |
| B-3 | ќпределить рЌ cока поджелудочной железы, если Ёƒ— цепи, составленной из стекл€нного электрода (e0ст.эл.=0,400 ¬) и хлорсеребр€ного(e0хс(нас) = 0,201 ¬), равна - 0,255 ¬ (“ = 298 ). |
¬ариант 3
„асть ј
1. акое утверждение ошибочно: стандартный электродный потенциал электрода 1 рода:
1) возникает на границе металл-раствор соли этого металла c активностью ионов 1 моль§л
2) зависит от природы металла
3) посто€нен при любой температуре
4) увеличиваетс€ с увеличением восстановительной способности металлов
2. ¬еличина потенциала свинцового электрода в 0,01 ћ растворе Pb(NO3)2 при “=298 (е0=-0,13в) равна:
1) -0,071¬
2) -0,189¬
3) -0,160¬
4) -0,100¬
3. „ем правее металл расположен в р€ду напр€жени€ (электрохимическом р€ду), тем:
1) сильнее его восстановительные способности
2) слабее окислительные способности его катионов
3) выше его стандартный электродный потенциал
4) больше электрическа€ подвижность катионов
4. акое утверждение ошибочно: потенциал водородного электрода
1) определ€етс€ по формуле  = - 0,059 рЌ
= - 0,059 рЌ
2) позвол€ет определить кислотность раствора
3)не зависит от температуры
4) зависит от активности ионов водорода
5. ¬одородный электрод Ч это:
1) ионселективный электрод,
2) окислительно-восстановительный,
3) обратимый I рода
4) ферментативный
6. акое утверждение ошибочно: хлорсеребр€ный электрод:
1)характеризуетс€ полуреакцией Ag+ + Cl-+ le-ЂAg∞ + Cl-
2) описываетс€ электрохимической схемой: Ag| AgCl, —l-
3) имеет стандартный потенциал равный 0,222 ¬
4) может быть использован дл€ определени€ pH биологических жидкостей как электрод сравнени€






