Пример 1. Составить молекулярные и ионно–молекулярные уравнения реакций водных растворов нитрата марганца(II) и гидроксида бария
Запишем уравнение реакции в молекулярной форме
Mn(NO3)2 + Ba(OH)2 = Ba(NO3)2 + Mn(OH)2
Используя таблицу растворимости солей, кислот и оснований в воде перепишем это уравнение для реального состояния веществ в растворе: растворимые в воде Mn(NO3)2, Ba(OH)2, Ba(NO3)2 (сильные электролиты) в виде ионов, а нерастворимый в воде Mn(OH)2 (слабый электролит) в молекулярном виде. Запишем ионно-молекулярное уравнение
Mn2+ + 2NO3- + Ba2+ + 2OH- = Mn(OH)2 + Ba2+ + 2NO3-.
Реакция может быть записана кратким ионно–молекулярным уравнением
Mn2+ + 2OH- = Mn(OH)2
Пример 2. Из раствора, в котором присутствуют ионы SO42-, OH-, Br-, извлечь OH-
Из раствора ионы можно извлечь, переводя их в нерастворимые соединения. Используя таблицу растворимости солей, кислот и оснований в воде, находим, что при добавлении иона Mn2+ образующиеся в результате протекающей в растворе реакции обмена MnSO4, и MnBr2являются растворимыми в воде солями, т.е. являются сильными электролитами и находятся в растворе в виде ионов. Mn(OH)2является нерастворимым в воде соединением и находится в растворе в молекулярном виде. Составим краткие ионно-молекулярные уравнения реакций
SO42- + Mn2+ = SO42- + Mn2+
Br- + Mn2+ = Br- + Mn2+
OH-+ Mn2+ = Mn(OH)2
Пример 3. Определить наличие ионов Ag+ в растворе, содержащем ионы Cu2+, Ag+
Определить наличие иона Ag+ в растворе можно, переводя его в нерастворимое соединение. Используя таблицу растворимости солей, кислот и оснований в воде, находим, что при добавлении иона Cl- образующаяся в результате протекающей в растворе реакции обмена CuCl2, является растворимой в воде солью, т.е. является сильным электролитом и находится в растворе в виде ионов. AgClявляется нерастворимым в воде соединением и находится в растворе в молекулярном виде. Составим краткие ионно-молекулярные уравнения реакций
Cu2++ Cl-= CuCl2,
Ag+ + Cl- = AgCl
Пример 4. Составить уравнение гидролиза и указать рН раствора фосфата калия.
Соль образована сильным основанием и слабой кислотой. Гидролиз карбоната натрия, протекает следующим образом:
I ступень. K3PO4 + HOH = K2HPO4 + KOH
PO43- + HOH = HPO42- + OH-,
II ступень. K2HPO4 + HOH = KH2PO4 + KOH
HPO42- + HOH = H2PO42- + OH-.
IIIступень практически не протекает.
При гидролизе ионы PO43--связывают ионы H+ из воды в слабый электролит HPO42. Ионы K+не могут связать OH- в молекулы, т.к. KOH является сильным электролитом. В растворе создается избыток OH-, поэтому раствор приобретает щелочную реакцию (pH>7).
Составление уравнения окислительно-восстановительной реакции в кислой среде.
Пример 5. Составить уравнение окислительно-восстановительной реакции взаимодействия перманганата калия и нитрита натрия в водном растворе серной кислоты.
1.Запишем схему окислительно-восстановительной реакции.
KMnO4 + NaNO2 + H2SO4  MnSO4 + NaNO3 + …
MnSO4 + NaNO3 + …
2.Определим, какие элементы изменили степень окисления.
+7 +3 +2 +5
KMnO4 + NaNO2 + H2SO4  MnSO4 + NaNO3 + …
MnSO4 + NaNO3 + …
Степень окисления изменили элементы марганец (Mn) и азот (N).
3. Используя таблицу растворимости солей, кислот и оснований в воде, запишемсхему реакции в кратком ионно-молекулярном виде:
MnO4- + NO2- + 2H+  Mn2+ + NO3- + …
Mn2+ + NO3- + …
MnO4- = Mn2+
NO2- = NO3-
4.Составим уравнения процессов окисления и восстановления, имея в виду, что реакция протекает в кислой среде:
MnO4- + 8H+ = Mn2+ +HOH
NO2- + HOH = NO3- + 2H+
5.Уравниваем левую и правую части уравнений по числу электронов.
Окислитель MnO4-+ 8H++ 5e = Mn2++HOH-реакция восстановление
Восстановитель NO2-+ HOH– 2e= NO3-+ 2H+ - реакция окисление.
6.Находим множители для полуреакций окисления и восстановления.
 Окислитель 2 MnO4-+ 8H++ 5e = Mn2++HOH - восстановление
Окислитель 2 MnO4-+ 8H++ 5e = Mn2++HOH - восстановление
Восстановитель 5 NO2-+ HOH– 2e= NO3-+ 2H+ - окисление.
7.Умножаем полуреакции на множители и суммируем.


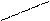
 2MnO4- + 616H+ + 5NO2- + 5H2O = 2Mn2+ + 38H2O + 5NO3- + 10H+
2MnO4- + 616H+ + 5NO2- + 5H2O = 2Mn2+ + 38H2O + 5NO3- + 10H+
8.Получаем уравнение в молекулярном виде:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
Вещество K2SO4 получилось в результате реакции ионного обмена.
9. Проведем проверку по кислороду
-2 -2
30 О = 30 О
Составление уравнения окислительно-восстановительной реакции в нейтральной среде.
Пример 6. Составить уравнение окислительно-восстановительной реакции взаимодействия перманганата калия и нитрита натрия в воде.
1.Запишем схему окислительно-восстановительной реакции.
KMnO4 + NaNO2 + H2O  MnO2 + NaNO3 + …
MnO2 + NaNO3 + …
2.Определим, какие элементы изменили степень окисления.
+7 +3 +4 +5
KMnO4 + NaNO2 + H2O  MnO2 + NaNO3 + …
MnO2 + NaNO3 + …
Степень окисления изменили элементы марганец (Mn) и азот (N).
3. Используя таблицу растворимости солей, кислот и оснований в воде, запишемсхему реакции в кратком ионно-молекулярном виде:
MnO4- + NO2- + H2O  MnO2 + NO3- + …
MnO2 + NO3- + …
MnO4- = MnO2 NO2- = NO3-
4.Составим уравнения процессов окисления и восстановления, имея в виду, что реакция протекает в нейтральной среде:
MnO4- + 2H2O = MnO2 +4OH-
NO2- + H2O = NO3- + 2H+
5.Уравниваем левую и правую части уравнений по числу электронов.
Окислитель MnO4-+ 2H2O+ 3e = MnO2+4OH--реакция восстановление
Восстановитель NO2-+ H2O– 2e= NO3-+ 2H+ - реакция окисление.
6.Находим множители для полуреакций окисления и восстановления.
 Окислитель 2 MnO4-+ 2H2O+ 3e = MnO2+4OH-- восстановление
Окислитель 2 MnO4-+ 2H2O+ 3e = MnO2+4OH-- восстановление
Восстановитель 3 NO2-+ HOH– 2e= NO3-+ 2H+ - окисление.
7.Умножаем полуреакции на множители и суммируем.

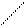

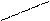 2MnO4- + 4H2O + 3NO2- + 3H2O = 2MnO2 + 3NO3- + 6H++8OH-
2MnO4- + 4H2O + 3NO2- + 3H2O = 2MnO2 + 3NO3- + 6H++8OH-
8.Получаем уравнение в молекулярном виде:
2KMnO4 + 3NaNO2 + H2O = 2MnO2 + 3NaNO3 + 2KOH
9. Проведем проверку по кислороду
-2 -2
15 О = 15 О
Составление уравнения окислительно-восстановительной реакции в основной среде.
Пример 7. Составить уравнение окислительно-восстановительной реакции взаимодействия перманганата калия и нитрита натрия в водном растворе гидроксида калия.
1.Запишем схему окислительно-восстановительной реакции.
KMnO4 + NaNO2 + КOH  K2MnO4 + NaNO3 + …
K2MnO4 + NaNO3 + …
2.Определим, какие элементы изменили степень окисления.
+7 +3 +6 +5
KMnO4+ NaNO2+ КOH  K2MnO4+ NaNO3+ …
K2MnO4+ NaNO3+ …
Степень окисления изменили элементы марганец (Mn) и азот (N).
3. Используя таблицу растворимости солей, кислот и оснований в воде, запишемсхему реакции в кратком ионно-молекулярном виде:
MnO4- + NO2- + OH-  MnO42- + NO3- + …
MnO42- + NO3- + …
MnO4- = MnO42- NO2- = NO3-
4.Составим уравнения процессов окисления и восстановления, имея в виду, что реакция протекает в нейтральной среде:
MnO4- = MnO42-
NO2-+ 2OH-= NO3-+ H2O
5.Уравниваем левую и правую части уравнений по числу электронов.
Окислитель MnO4-+ 1e = MnO42- - реакция восстановление
Восстановитель NO2-+ 2OH-– 2e= NO3-+ H2O- реакция окисление.
6.Находим множители для полуреакций окисления и восстановления.
 Окислитель 2 MnO4-+ 1e = MnO42- - - восстановление
Окислитель 2 MnO4-+ 1e = MnO42- - - восстановление
Восстановитель 1 NO2-+ 2OH- – 2e= NO3-+ H2O- окисление.
7.Умножаем полуреакции на множители и суммируем.
2MnO4- + NO2- + 2OH- = 2MnO42- + NO3- + H2O
8.Получаем уравнение в молекулярном виде:
2KMnO4+ NaNO2+ 2КOH= 2K2MnO4+ NaNO3+ H2O
9. Проведем проверку по кислороду
-2 -2
12 О = 12 О
Составление уравнения окислительно-восстановительной реакции для реакции, в которой степень окисления изменяется у одного и того же элемента, входящего в состав различных молекул.
Пример 8. Составить уравнение окислительно-восстановительной реакции взаимодействия перманганата калия и сульфата марганца в водном среде.
1.Запишем схему окислительно-восстановительной реакции.
KMnO4 + MnSO4 + H2O  MnO2 + …
MnO2 + …
2.Определим, какие элементы изменили степень окисления.
+7 +2 +4
KMnO4+ MnSO4+ H2O  MnO2+ …
MnO2+ …
Степень окисления изменил элементмарганец (Mn).
3. Используя таблицу растворимости солей, кислот и оснований в воде, запишемсхему реакции в кратком ионно-молекулярном виде:
MnO4- + Mn2+ + H2O  MnO2 + …
MnO2 + …
MnO4- = MnO2 Mn2+ = MnO2
4.Составим уравнения процессов окисления и восстановления, имея в виду, что реакция протекает в нейтральной среде:
MnO4- + 2H2O = MnO2 + 4ОН- Mn2+ +2H2O = MnO2 + 4Н+
5.Уравниваем левую и правую части уравнений по числу электронов.
Окислитель MnO4-+ 2H2O+3e= MnO2+ 4ОН- - реакция восстановление
Восстановитель Mn2++2H2O- – 2e= MnO2+ 4Н+- реакция окисление.
6.Находим множители для полуреакций окисления и восстановления.
 Окислитель 2 MnO4-+ 2H2O+3e= MnO2+ 4ОН- - - восстановление
Окислитель 2 MnO4-+ 2H2O+3e= MnO2+ 4ОН- - - восстановление
Восстановитель 3 Mn2++2H2O- – 2e= MnO2+ 4Н+ - окисление.
7.Умножаем полуреакции на множители и суммируем.
2MnO4-+ 3Mn2++ 10H2O= 5MnO2+ 8ОН- + 12Н+
8.Получаем уравнение в молекулярном виде:
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + 2H2SO4+ K2SO4
Вещество K2SO4 получилось в результате реакции ионного обмена.
9. Проведем проверку по кислороду
-2 -2
22 О = 22 О
Составление уравнения окислительно-восстановительной реакции для реакции самоокисления-самовосстановления – реакции, в которой степень окисления изменяется у одного и того же элемента, входящего в состав одного и того же вещества
Пример 9. Составить уравнение окислительно-восстановительной реакции взаимодействия хлора с водным раствором гидроксида калия
1.Запишем схему окислительно-восстановительной реакции.
Cl2 + KOH  KCl + KClO3 + …
KCl + KClO3 + …
2.Определим, какие элементы изменили степень окисления.
0 -1 +5
Cl2 + KOH  KCl+ KClO3+ …
KCl+ KClO3+ …
Степень окисления изменил элемент хлор (Cl).
3. Используя таблицу растворимости солей, кислот и оснований в воде, запишемсхему реакции в кратком ионно-молекулярном виде:
Cl2 + OH-  Cl- + ClO3- + …
Cl- + ClO3- + …
Cl2 = Cl-
Cl2= ClO3-
4.Составим уравнения процессов окисления и восстановления, имея в виду, что реакция протекает в нейтральной среде:
Cl2 = 2Cl-
Cl2 + 12OH- = 2ClO3- + 6H2O
5.Уравниваем левую и правую части уравнений по числу электронов.
Окислитель Cl2 + 2e = 2Cl-- реакция восстановление
Восстановитель Cl2 + 12OH-– 10e= 2ClO3- + 6H2O- реакция окисление.
6.Находим множители для полуреакций окисления и восстановления.
 Окислитель 2 Cl2 + 2e = 2Cl-- восстановление
Окислитель 2 Cl2 + 2e = 2Cl-- восстановление
Восстановитель 1 Cl2 + 12OH-– 10e= 2ClO3- + 6H2O- окисление.
7.Умножаем полуреакции на множители и суммируем.
5Cl2 + Cl2 + 12OH- = 10Cl- +2ClO3- + 6H2O
8.Получаем уравнение в молекулярном виде:
6Cl2 + 12KOH= 10KCl+ 2KClO3+ 6H2O
9. Проведем проверку по кислороду
-2 -2
12 О = 12 О






