Интенсивность присоединения или отдачи электронов различными ионами измеряется окислительно-восстановительным редокс-потенциалом (ОВП).
Редокс-потенциал определяют электрохимическими методами. Чем больше редокс-потенциал данного вещества, тем интенсивнее окисляющее действие, а чем меньше потенциал, тем интенсивнее восстанавливающее действие данного вещества.
При погружении электрода в раствор окислителя или восстановителя он отдает или принимает электроны. Электрод будет заряжаться положительно или отрицательно до определенно потенциала, уравновешивающего стремление электронов к перераспределению, причем положительный заряд электрода становится тем выше, чем сильнее окислительные свойства раствора. Потенциал, до которого заряжается электрод при погружении его в данный раствор, является мерой окислительной активности последнего. Его называют электродным окислительным потенциалом раствора (ЭП).
Обычно раствор содержит окислитель и восстановитель. Чем сильнее указанный окислитель в паре, тем должен быть слабее восстановитель, и наоборот.
Напишем уравнение реакции окисления иодид – ионов ионами Fe3+ в сокращенном ионном виде:
2Fe3++2I-=2Fe2++I2
Окислительно-восстановительные пары в этой реакции составляют:
1-ая: Fe3+ (окисленная форма) – Fe2+ (восстановленная форма)
Окислитель 1 Восстановитель 1
2-ая: I2 (окисленная форма) – I- (восстановленная форма)
Окислитель 2 Восстановитель 2
При обозначениях окислительно-восстановительных пар слева указывают окислитель. Приведем еще несколько окислительно-восстановительных пар: Cl2/Cl-, Br2/Br-, I2/I-, Fe3+/Fe2+, SO42-/So32- и др.
Значение окислительно-восстановительного потенциала зависит от природы окислителя и восстановителя, от их концентраций и температуры. Зависимость окислительно-восстановительного потенциала от различных факторов выражается уравнением В. Нернста, выведенным на основе законов термодинамики:
φ = φ0+ RT ln [Ок],
nF [Восст]
где φ0- стандартный электродный потенциал при активности (концентрации ионов), равной единице.
R- газовая постоянная, равная 8, 313 Дж/моль∙К,
Т- абсолютная температура, К;
n- число электронов (отдаваемых или присоединяемых);
F-число Фарадея (96500 Кл).
Для расчета удобно пользоваться упрощенной формулой при Т=298К, которая получается после подстановки численных значений констант и перехода к десятичным логарифмам уравнение принимает вид:

Абсолютное значение электродного потенциала определить нельзя!
На практике применяют величину относительного потенциала другого электрода, принятого за стандарт. Последний называется электродом сравнения. Электрод с неизвестным потенциалом называется электродом измерения, или индикаторным электродом. В качестве электрода сравнения используют стандартный водородный электрод, потенциал которого принят за нуль.
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую порошком Pt, которая опущена в раствор соляной кислоты или серной с активностью ионов H+, равной 1моль/л и омывается током водорода при давлении 101,3 кПа.
Если расположить металлы в порядке возрастания значений их стандартных потенциалов, то получается электрохимический ряд напряжений или ряд стандартных ЭП.
Правило определения знака ЭП: если в паре со стандартным водородным электродом на электроде идет реакция окисления, ЭП имеет знак «минус», если реакция восстановления – знак «плюс».
Чтобы определить стандартный потенциал какой-либо данной пары, например, Fe3+/Fe2+, ее комбинируют со стандартным водородным электродом в гальванический элемент (ГЭ). ГЭ – это устройство, в котором энергия химической реакции преобразуется в электрическую. Он состоит из двух полуэлементов или электродов и может быть химическим и концентрационным. В основе работы химического ГЭ лежит окислительно-восстановительная реакция. На электродах при этом происходят следующие реакции:
H2-2ē↔2H+
2Fe3++2ē↔2Fe2+
Э.д.с. оказывается равной 0,77В. Так как она представляет собой и разность стандартных потенциалов, то:
Е= φ0 Fe3+/Fe2+ - φ02Н+/Н2=0,77В.
Так как стандартный водородный потенциал принят равным нулю, то 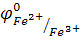 =0,77 В
=0,77 В
Для учета эффекта кислотности среды, т.е. для характеристики окислительно-восстановительной системы в конкретных условиях, используют понятие реального стандартного потенциала φ0´. При этом исходные концентрации окисленной и восстановленной форм потенциалопределяющих ионов полагают равным 1 моль/л (концентрации всех прочих компонентов данного раствора считают зафиксированными). Реальный стандартный потенциал системы в зависимости от кислотности может изменяться в широком диапазоне в соответствии с формулой:

Чем выше концентрация ионов водорода в растворе (ниже значение рН), тем более высок реальный стандартный потенциал, т.е. тем большей окислительной способностью обладает окисленная форма. Реальным стандартным потенциалом можно пользоваться только при том значении рН раствора, при котором он вычислен.
Изменяя рН можно увеличить или уменьшить окислительно-восстановительный потенциал. Кроме того, изменяя рН, можно изменить направление окислительно-восстановительной реакции.
Значения стандартных электродных потенциалов, измеренных относительно стандартного водородного электрода, приведены в справочной литературе. Однако по величине стандартных электродных потенциалов можно лишь качественно оценить направление окислительно-восстановительных реакций.
Пример. Отрицательный знак электродного потенциала цинка  B означает, что равновесие в реакции Zn2++H2↔Zn+2H+ смещено влево.
B означает, что равновесие в реакции Zn2++H2↔Zn+2H+ смещено влево.
Количественная оценка направления окислительно-восстановительных реакций осуществляется по константе равновесия (чем больше константа равновесия, тем полнее идет химическое взаимодействие), определяемой по уравнению:
lgK=  ∙n,
∙n,
где n- число электронов, переходящих от восстановителю к окислителю.
Из последней формулы видно, что чем больше разность стандартных потенциалов сопряженных пар окислителя и восстановителя, тем больше константа равновесия.




