Мета роботи. Опанувати методику потенціометричного титрування, визначити концентрацію розчину кислоти, розрахувати рН розчину кислоти, а також рН розчину у точці еквівалентності.
Методика роботи. Хід багатьох процесів, що відбуваються як у природних, так і у штучних системах, визначається наявністю в розчинах іонів водню. Значна кількість реакцій протікає в потрібному напрямку тільки за певної активності іонів водню. Тому методи швидкого і точного визначення активності (концентрації) іонів водню мають велике значення. Оскільки в реальних розчинах концентрація іонів водню може змінюватись у дуже широких межах (від ~ 10 моль/л до 10-14 моль/л і менше), виявилося більш зручним характеризувати активність водневих іонів водневим показником (рН). рН - це десятковий логарифм активності водневих іонів, взятий із знаком "мінус":
 . (1)
. (1)
У розведених розчинах активність іонів є близькою до їх концентрації, тому
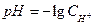 . (2)
. (2)
Найчастіше рН знаходиться у межах від 0 до 14, хоча в окремих випадках може бути як менше нуля, так і більше 14. Так, якщо  , то рН -0,3, а в лужному розчині за
, то рН -0,3, а в лужному розчині за 
 і рН 14,3.
і рН 14,3.
рН можна визначати за допомогою кольорових індикаторів, проте точність такого визначення є незначною і є неможливим у забарвлених або каламутних розчинах.
Найбільш розробленим і точним зараз є електрометричний метод визначення рН, що грунтується на вимірюванні величини потенціалу електродів, обернених відносно іонів водню: водневого, хінгідронного, скляного.
Водневий електрод складається з пластинки платинованої платини, частково зануреної в розчин, що містить іони водню, через який пропускають газоподібний водень. У водневому електроді встановлюється рівновага:
 (3)
(3)
Потенціал його виражається рівнянням Нернста
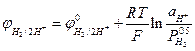 , (4)
, (4)
де 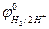 - стандартний потенціал водневого електрода, прийнятий за міжнародною угодою рівним нулю, а
- стандартний потенціал водневого електрода, прийнятий за міжнародною угодою рівним нулю, а  - рівноважний тиск водню, атм.
- рівноважний тиск водню, атм.
Звичайно вимірювання рН проводять за  , тому за кімнатної температури (Т = 298 К; R = 8,3144 Дж∙моль-1∙К-1; F = 96500 Кл; 1 Дж = 1 Кл∙В) потенціал водневого електрода у вольтах має вигляд:
, тому за кімнатної температури (Т = 298 К; R = 8,3144 Дж∙моль-1∙К-1; F = 96500 Кл; 1 Дж = 1 Кл∙В) потенціал водневого електрода у вольтах має вигляд:
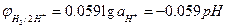 . (5)
. (5)
Хінгідронний електрод являє собою платинову пластинку, занурену в досліджуваний розчин, насичений хінгідроном - еквімолекулярною сполукою хінону і гідрохінону. У розчині встановлюється рівновага
 , (6)
, (6)
хінгідрон (х.г.) хінон (х) гідрохінон (г.х.)
а на електроді – рівновага
 . (7)
. (7)
Рівняння Нернста для хінгідронного електрода
 , (8)
, (8)
Оскільки хінон і гідрохінон у розчині утворюються в результаті розпаду хінгідрону за рівнянням (6), їх концентрації (і активності) є рівними і у формулі (8) скорочуються. Тому вираз для електродного потенціалу має вигляд:
 . (9)
. (9)
Для виготовлення хінгідронного електрода в розчин, що досліджується, вносять таку кількість твердого хінгідрону, за якої частина його після насичення розчину залишалася б в осаді. Оскільки хінгідрон є мало розчинним у воді, для насичення розчину потрібна дуже мала його кількість.
Таким чином, як видно з рівнянь (5) та (9), для визначення рН розчину необхідно вимірювати електродні потенціали водневого або хінгідронного електроду. Електродні потенціали в свою чергу знаходять, вимірюючи електрорушійну силу (ЕРС) гальванічного елемента, побудованого з робочого (індикаторного) електроду (водневого або хінгідронного) та електроду порівняння, потенціал якого є точно відомим. Як електроди порівняння використовують каломельний або хлорсрібний електроди.
ЕРС гальванічного елемента, побудованого із двох електродів, дорівнює різниці їх електродних потенціалів. Так, у разі використання хінгідронного електроду як індикаторного і хлорсрібного як електрода порівняння ЕРС дорівнює
 . (10)
. (10)
Вимірявши електрорушійну силу Е і знаючи потенціал хлорсрібного електрода φAgCl за рівнянням (10) знаходять потенціал індикаторного електрода φх.г. і далі рН за рівнянням (9):
 . (11)
. (11)
Стандартний потенціал хінгідронного електрода  за 25°С дорівнює 0,699 В. Потенціал хлорсрібного електрода порівняння, виготовленого на насиченому розчині KCl, за тих самих умов дорівнює 0,222 В. Тому рівняння (11) можна переписати і, таким чином,
за 25°С дорівнює 0,699 В. Потенціал хлорсрібного електрода порівняння, виготовленого на насиченому розчині KCl, за тих самих умов дорівнює 0,222 В. Тому рівняння (11) можна переписати і, таким чином,
 . (12)
. (12)
Електрорушійну силу вимірюють компенсаційним методом за допомогою спеціальних приладів - потенціометрів.
Потенціометричне титрування полягає у знаходженні еквівалентної точки за зміною потенціалу індикаторного електрода при додаванні до розчину електроліту титрованого розчину. Індикаторний електрод повинен бути оберненим по відношенню до іонів, якими титрують, або по відношенню до іонів розчину, що титрується. Оскільки у ході титрування концентрація іонів, що визначають потенціал електрода, змінюється, повинен змінюватись (відповідно до рівняння Нернста) і сам електродний потенціал. На початку титрування потенціал індикаторного електрода змінюється повільно, але при наближенні до еквівалентної точки швидкість зміни потенціалу зростає. Так, при титруванні сильної кислоти лугом з використанням хінгідронного електрода в ролі індикаторного залежність його потенціалу від об'єму доданого титрованого розчину лугу (крива титрування) має вигляд, як показано на рис. 1. Еквівалентну точку а знаходять шляхом опускання перпендикуляра на вісь ОХ з точки перегину. Значення еквівалентної точки не зміниться, якщо побудувати криву титрування, використовуючи замість величини потенціалу індикаторного електрода значення електрорушійної сили, бо, як видно з рівняння (10), вони відрізняються на сталу величину потенціалу електрода порівняння φAgCl.
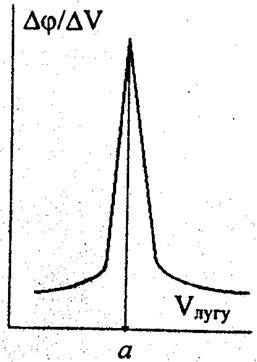
Положення еквівалентної точки встановлюється більш точно при використанні іншого варіанта кривої титрування, коли по осі ОY відкладають не потенціал індикаторного електрода φ (або Е), а відношення зміни потенціалу Δφ до відповідної зміни об'єму доданого титрованого розчину ΔЕ. При цьому отримують диференціальну криву титрування, зображену на рис. 2. Для побудови диференціальної кривої також замість φ використовують безпосередньо виміряні Е, бо
 .
.

| 
|
| Рис. 1. Крива титрування сильної кислоти лугом. | Рис. 2. Диференціальна крива титрування сильної кислоти лугом. |
При титруванні сильної кислоти лугом концентрацію іонів водню в еквівалентній точці можна розрахувати за формулою:
 , (13)
, (13)
і, отже, рН розчину дорівнює  .
.
При титруванні слабких кислот стрибок потенціалу в еквівалентній точці виражений не так різко, що інколи утруднює визначення точки перегину (див. рис. 3).
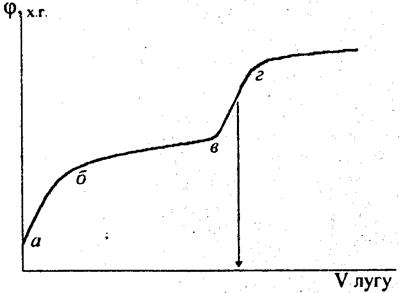
| Рис. 3. Крива титрування слабкої кислоти лугом. |
На кривій титрування початковий крутий відрізок аб відповідає швидкому зменшенню концентрації іонів водню в розчині при додаванні невеликої кількості лугу внаслідок слабкої дисоціації кислоти. Пологий відрізок бв відповідає незначній зміні концентрації іонів водню в розчині при подальшому додаванні лугу, що зумовлено буферними властивостями розчину після утворення в ньому солі за часткової нейтралізації кислоти. Крутий відрізок вг відповідає швидкій зміні концентрації іонів водню поблизу еквівалентної точки. Концентрація іонів водню і рН в цьому випадку виражаються рівняннями:
 ; (14)
; (14)
 , (15)
, (15)
де Кдис - константа дисоціації кислоти; Кв - іонний добуток води; С - початкова концентрація слабкої кислоти;  .
.
При титруванні слабкої кислоти лугом розчин в еквівалентній точці має лужні властивості внаслідок гідролізу утвореної солі.
Для визначення концентрації речовин методом потенціометричного титрування можна використовувати не тільки реакції нейтралізації, але й реакції окиснення - відновлення й ін. Перевагою потенціометричного титрування є можливість використання його для аналізу забарвлених та каламутних розчинів, а також висока чутливість, що іноді перевищує чутливість титрування з кольоровими індикаторами.
Порядок роботи. Складають гальванічний елемент з індикаторного (хінгідронного) електрода та електрода порівняння (хлорсрібного), як показано на рис. 4. Для виготовлення хінгідронного електрода в склянку наливають досліджуваний розчин 5, додають невелику кількість хінгідрону і вміст добре розмішують.

|
| Рис. 4. Схема гальванічного елемента для визначення рН та потенціометричного титрування: 1 - хлорсрібний електрод; 2 - розчин KCl; 3 - сольовий місток; 4 - платиновий дріт для підведення струму; 5 - розчин, що досліджується. |
Для підведення струму в розчин занурюється платинова дротинка, впаяна в скляну трубочку 4. Індикаторний електрод з'єднується з електродом порівняння сольовим містком 3, заповненим гелем агар-агару, виготовленим на розчині KCl.
Вимірювання електрорушійної сили гальванічного елемента здійснюється компенсаційним методом (за допомогою потенціометра).
Титрування робочого розчину кислоти здійснюється 0,1 н розчином NaOH, який порціями по 0,5 мл подають із бюретки. Після додавання кожної порції, розчин в індикаторному електроді ретельно розмішують і вимірюють ЕРС елемента Е.
На початку титрування розчин лугу додають великими порціями (0,5 - 1 мл) і слідкують за зміною ΔЕ/ΔV. При наближенні до еквівалентної точки величина ΔЕ/ΔV починає швидко збільшуватись, і тоді титрований розчин починають додавати меншими порціями (0,1 - 0,05 мл). Коли величина ΔЕ/ΔV почне зменшуватись, порції розчину лугу знову збільшують до 0,5 мл.
У ході титрування рН розчину зростає і, як видно з рівняння (9), потенціал індикаторного електрода зменшується і за певного рН (близько 8) досягає величини потенціалу хлорсрібного електрода. У цей момент знак ЕРС гальванічного елемента змінюється, і необхідно поміняти місцями кінці проводів на клемах потенціометра.
Титрування продовжують до одержання двох-трьох вимірів після зміни знаку ЕРС. Будують залежність Е від об'єму доданого лугу і диференціальну криву потенціометричного титрування. Визначають об'єм лугу, що пішов на титрування.
Спочатку виконують тренувальну задачу. Для цього в склянку індикаторного електроду наливають 5 мл 0,1 н HCl, дистильованою водою доводять об'єм до приблизно 2/3 об'єму склянки, додають хінгідрон і титрують. У разі отримання очікуваного результату переходять до виконання контрольної задачі. Одержують у викладача розчин, об'єм якого або концентрація кислоти в якому не відомі, і проводять його аналіз потенціометричним титруванням. Невідому величину (об'єм розчину або концентрацію) розраховують, користуючись рівнянням 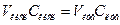 .
.
Розраховують значення рН вихідного розчину, розчину в еквівалентній точці і розчину після закінчення титрування.
Література: [21,24].
Список літератури
1. Даниэль Ф. Олберти Р. Физическая химия. - М., 1978.
2. Эткинс П. Физическая химия: В 2 т. - М., 1980.
3. Курс физической химии / Под ред. Я.И.Герасимова: В 2 т. - 1973.
4. Стромберг А.Г., Семченко Д.П. Физическая химия. - М., 1988.
5. Товбин М.В. Физическая химия.- К., 1975.
6. Яцимірський В.К. Фізична хімія рівноважних систем. - К., 1992.
7. Физическая химия / Под ред. К.С.Краснова. - М., 1982.
8. Карапетьянц М.Х. Химическая термодинамика. - М., 1975.
9. Жуховицкий А.А., Шварцман Л.А. Физическая химия. - М., 1987.
10. Филиппов Ю.В., Попович М.Ц. Физическая химия. - М., 1980.
11. Мельвин-Хьюз З.А. Физическая химия: В 2 т. - М., 1962.
12. Дамаскин В.В., Паврий О.А. Электрохимия. - М., 1987.
13. Еремин Е.Н. Основы химической термодинамики. - М., 1978.
14. Делисов Е.Т. Кинетика гомогенных химических реакций. - М., 1988.
15. Эйринг Г.Э., Лин С.Г., Лин С.М. Основы химической кинетики. - М., 1983.
16. Панченко Г.М., Лебедев В.М. Химическая кинетика и катализ. – М., 1974.
17. Грег С., Синг К. Адсорбция, поверхность, пористость. - М., 1984.
18. Дальмон Б. Кинетика гетерогенных реакций. - М., 1972.
19. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. – М., 1984.
20. Баталин Г.И., Стахов Д.А. Методические указания к лабораторным работам по физической химии. - К., 1982.
21. Практические работы по физической химии / Под ред. К.П. Мищенко, А.А. Равделя - Л., 1982.
22. Практикум по физической химии / Под ред. И.В. Кудряшова - М., 1986.
23. Практикум по физической химии / Под ред. В.В. Буданова – М., 1986.
24. Практикум по физической химии / Под ред. С.В. Горбачева – М., 1974.
25. Практикум по физической химии / Под ред. Н.К. Воробьева – М., 1975.
26. Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.А. Пономаревой. - Л., 1993.
27. Шаталов А.Я., Маршаков И.Н. Практикум по физической химии. - М., 1975.
Упорядники:
ЯЦИМИРСЬКИЙ Віталій Костянтинович
ЄРЕМЕНКО Борис Валентинович
СУДАВЦЕВА Валентина Савелівна
БЄЛОБОРОДОВА Олена Арсенівна
КАЗИМІРОВ Володимир Петрович
ЗАБУГА Віктор Якович
СТАХОВ Дмитро Андрійович
ІЩЕНКО Олена Вікторівна
БУДАРІН Віталій Львович
ОЛЕКСЕНКО Людмила Петрівна
МАЛИШЕВА Марія Львівна
Редактор Н.О.Витвицька
1. Детально термометр Бекмана та порядок роботи з ним описано в роботі № 2/1.
[2] Посудину Бойля-Маріотта 22 разом з циліндром 23 може бути замінено бюреткою з пристроєм знизу для подачі піни водного розчину ПАР; швидкість газу при цьому визначають за часом проходження плівки від нижньої позначки бюретки до верхньої.
[3] Якщо вважати, що концентрації розчинів протягом часу виконання роботи не змінюються, можна обмежитись титруванням лише вихідних розчинів. За однакових нормальностей вихідних розчинів відношення концентрації три- і дво-валентного заліза, яке необхідне для розрахунків, можна замінити відношенням об'ємів вихідних розчинів, що йдуть на виготовлення сумішей.






