Методические указания по выполнению расчетного задания №4
1.Перед выполнением задач прочтите материал лекций, учебника [2] и главы 7-8 пособия [3].
2. Разберите примеры аналогичных задач в сборнике [4] и пособии[3].
3.Справочные данные Вы найдете в [1].
Рекомендуемая литература
1.Краткий справочник физико - химических величин./ Под ред. Равделя и Пономаревой.2010.
2.Н.В.Коровин Н.В. Общая химия: учебник -13 изд., - М.: Изд.центр Академия, 2011.
3. Общая химия. Теория и задачи: Учебное пособие / Под ред. Н.В. Коровина и Н.В. Кулешова – СПб.: Изд. Лань, 2014.
4.Задачи и упражнения по общей химии. Под ред. Н.В.Коровина. М.:Высшая школа, 2006.
Примеры решения типовых задач по теме
Задача 1. Для бромно-серебряного гальванического элемента:
-составьте уравнения анодной, катодной и токообразующей реакций;
рассчитайте стандартную ЭДС элемента при 298К двумя способами и ЭДС элемента, активность потенциалопределяющих ионов ai анода в котором уменьшена в 100 раз;
- объясните, почему напряжение элемента меньше ЭДС, покажите ход поляризационных кривых и предложите условия, позволяющие увеличить напряжение;
- рассчитайте величину максимальной теоретической энергии Wмакс (Вт ∙ч), которая могла быть выработана ГЭ при работе, если уменьшение массы анода (в результате анодной реакции) составило 10,8 грамма (принять, что состояния всех веществ - стандартные при 298 К).
Решение. Так как Е 0Ag < Е 0Br2, анод –серебряный электрод. Уравнения процессов, протекающих на аноде и катоде в работающем ГЭ и уравнение токообразующей реакции:
А: 2Аg → 2Аg+ + 2е - окисление
К: Br2 + 2е → 2Br - - восстановление
ТОР: 2Аg + Br2 ↔ 2Аg+ + 2Br -
Рассчитываем ЭДС (Е 0Э) ГЭ при с.с. и 298 К, используя термодинамические данные справочника:
D f G 0Ag+ = 77,10 кДж/моль; D f G 0 Br- = -104,04 кДж/моль;
D f G 0 Ag = 0; D f G 0 Br2 = 3,14 кДж/моль.
Итак, стандартная энергия Гиббса и стандартная ЭДС данного ГЭ при 298 К равны:
D G 0ТОР = 2D f G 0Ag+ + 2D f G 0 Br- - 2D f G 0 Ag - D f G 0 Br2 =
= 2. 77,10 + 2. (-104,04) - 0 - 3,14 = -57,02 кДж.
Е 0Э = - D G 0ТОР / nF = - (-57020) / (2. 96500) =
0,266 B.
Второй способ нахождения ЭДС (по определению):
Е 0Э = Е 0К - Е 0А = Е 0 Br2 /Br - - Е 0 Аg+/Аg = 1,065 - 0,799 = 0,266 В.
Рассчитаем ЭДС (Е Э) ГЭ при уменьшении активности потенциалопределяющих ионов анода (ai) в 100 раз, считая активность ионов катода и парциальное давление газов стандартными, Т = 298 К по уравнению Нернста:
Е Э = Е 0Э +  ln
ln 
Подставляя в уравнение известные величины:
 Br2= 105 Па/105 Па = 1, а Br- = 1 моль/л; а Аg+ =0,01 моль/л получаем:
Br2= 105 Па/105 Па = 1, а Br- = 1 моль/л; а Аg+ =0,01 моль/л получаем:
Е Э = 0,266 +  lg
lg  = 0,266+ 0,118 = 0,384 В.
= 0,266+ 0,118 = 0,384 В.
Величина максимальной теоретической энергии Wмакс, которая могла бы быть выработана ГЭ и отдана им при разряде равна:
W макс = Q∙E э, где Q-емкость (количество электричества, отдаваемое при разряде), Еэ-стандартная ЭДС
Q определим по следствию из 2-го закона Фарадея:
Q = (1 F/ 1м-э )/(m/M)= ( 26,8А∙ч /1м-э) ∙ (10,8 г/108г/м-э) = 2,68 А∙ч
Сл-но, энергия W макс ГЭ, отданная им при разряде с потерей массы Ag-анода в 10,8 грамм равна:
W макс = Q∙E э0== 2,68 А∙ч ∙ 0,266 В=0,69 Вт∙ч.
Равновесные потенциалы электродов и ЭДС могут быть определены в условиях отсутствия тока в цепи. В работающем ГЭ при прохождении электрического тока уменьшается концентрация исходных реагентов и увеличивается концентрация продуктов реакции: потенциал анода становится менее отрицательным, потенциал катода – менее положительным(поляризация электродов). Помимо этого возникают омические потери. В результате напряжение ГЭ меньше ЭДС: U = Е Э - I . R - D Е А -D Е К ,
Изменение потенциалов электродов под действием тока отражают поляризационные кривые:

Для увеличения напряжения данного ГЭ можно:
- Снизить поляризацию электродов. Для этого обеспечить постоянный подвод реагентов (Br2), отвод продуктов реакции (Br- и Аg+); обеспечить перемешивание раствора; применить катализатор; повысить температуру; повысить площадь поверхности электродов (пористые, гофрированные электроды).
- Уменьшить сопротивление системы путем сближения анода и катода, применением проводников с низким сопротивлением.
Задача 2. Рассчитайте толщину δ никелевого гальванопокрытия стального изделия, поверхностью 1 м2 при никелировании с никелевым анодом в течение 1 часа из водного раствора на основе NiSO4, при плотности тока – 100 А/м,2 выходе по току Ni на катоде – 0,8 (плотность Ni ρ= 8,9 г/см3, рН раствора принять равным 7).
Решение. Ионный состав: H+, Ni2+, OH-, SO42-.
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
[- K]: Ni2+ + 2 e → Ni
2Н+ + 2 е → Н2↑
[+A, Ni]: Ni → Ni2+ + 2 e
4ОН- → О2 ↑ + 2Н2О + 4 е
По объединенному уравнению законов Фарадея масса никеля, восстановленного на катоде:

Т.к. объем V = m/ρ = S∙δ, то толщина никелевого покрытия на изделии равна:
 (9,84 мкм)
(9,84 мкм)
Задача 3. Для водного раствора ZnCl2:
-составьте уравнения электродных процессов при гальванопокрытии Fe-изделия при электролизе с графитовым(C) анодом ;
- изменяется ли реакция среды при электролизе,
-покажите ход поляризационных кривых
- чему равна теоретическая минимальная разность потенциалов U разл, которую необходимо подать на электроды для начала проведения электролиза.
Решение. Определим ионный состав раствора электролита и оценим водородный показатель среды pH.
ZnCl2 → Zn2+ + 2Cl-
H2O ↔ H+ + OH-
Соль ZnCl2 образована слабым основанием Zn(OН)2 и сильной кислотой HCl, следовательно, при ее растворении в воде протекает процесс гидролиза с образованием избытка ионов Н+, и раствор электролита имеет слабокислую реакцию среды. Примем рН=5. Определим равновесные потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов. Е 0Zn2+/Zn = -0,763 B -справочные данные[1],
Е Н+/Н2 = - 0,059 . pH = -0,295 B (по уравнению Нернста при 298 К). Т.к. значения потенциалов Е 0Zn2+/Zn и Е Н+/Н2 близки (<1 В), то на катоде будут протекать два процесса восстановления(ионов Zn2+ и ионов Н+ из раствора электролита).
C - нерастворимый анод, поэтому возможно окисление ионов Cl- и OH- . E0 Cl2 /Cl- =1,359B. По уравнению Нернста при 298 К: E О2 / ОН- = 1,23 - 0,059 .pH = + 0,935 В. Т.к. значения потенциалов Е 0Cl2/Cl- и E О2 / ОН- близки (<1 В), то на
аноде будут идти оба процесса окисления.
К(Fe) -: 2Н+ + 2e → Н2
Zn2+ + 2e → Zn
A(C)+: 4OH- → 2O2 + 4H+ + 4 e
2Cl- → Cl2 + 2 e
В ходе процесса электролиза на катоде расходуются ионы Н+ - среда становится менее кислой; на аноде образуются ионы Н+ - среда дополнительно подкисляется.
При прохождении тока через электролизер изменяются потенциалы электродов электролизера, т.е. возникает электродная поляризация. В результате катодной поляризации потенциал катода становится более отрицательным; в результате анодной поляризации потенциал анода становится более положительным. Изменение потенциалов электродов при прохождении тока отражают поляризационные кривые.

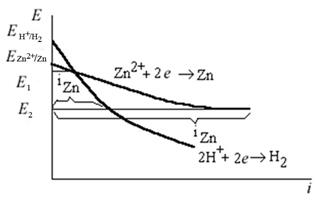
Кроме того, имеются омические потери в проводниках 1-го и 2-го рода. В результате напряжение электролизера больше теоретической минимальной разности потенциалов, которую необходимо подать на электроды для начала проведения электролиза (напряжения разложения):
U = U разл + I . R + D Е А +D Е К,
U разл, равна разнице равновесных потенциалов первых процессов, протекающих на аноде и катоде:
U разл = Е А - Е К = E р О2 / ОН- - Е р Н+/Н2 = 0,935- (-0,295) = 1,23 В.






