На початку кожного семестру викладач проводить інструктаж групи студентів про дотримання правил роботи в хімічній лабораторії та техніки безпеки. Студенти підтверджують знання правил безпеки власними підписами у журналі.
Нещасні випадки (опіки, поранення, отруєння) в лабораторії виникають внаслідок недостатнього ознайомлення працюючих з відповідними інструкціями по охороні праці і техніці безпеки або в результаті необережності у роботі.
У кожній лабораторії повинна бути аптечка першої допомоги.
Якщо нещасний випадок трапився, потерпілому треба надати першу допомогу:
1. При попаданні на шкіру кислот, це місце слід інтенсивно промити водою, а потім 1% розчином NaHCO3. При попаданні концентрованої сірчаної кислоти перед промиванням пошкоджену шкіру необхідно витерти сухим ватним тампоном.
2. При попаданні на шкіру розчинів лугів пошкоджене місце промивають водою, а потім розведеними оцтовою, лимонною кислотами, або насиченим розчином борної кислоти.
3. При попаданні на шкіру фенолу, брому і подібних їм речовин необхідно негайно пошкоджене місце промити відповідними органічними розчинниками (спирт, ефір тощо).
4. При отруєнні хлором, бромом, оксидами нітрогену потерпілому необхідно вдихати пари розведеного розчину амоніаку і випити молоко.
5. При опіках тіла полум’ям необхідно негайно промити місце опіку 1% розчином калію перманганату і покласти на пошкоджене місце компрес із спиртового розчину таніну.
6. При порізах рану необхідно обробити спиртовим розчином йоду і перев’язати.
7. Після надання першої допомоги потерпілому, його терміново необхідно відправити до лікарні.
Основні способи очищення неорганічних речовин
1. Значення теми: В хімічній практиці велике значення має ступінь очищення речовин, так як робота з забрудненими реактивами може призвести до помилкових результатів. Чистота речовин, які використовуються як лікарські препарати, визначається Державною Фармакопеєю України і тому фармацевтам потрібно знати основні методи очищення і засоби ідентифікації чистоти речовин.
2. Основні питання теми:
2.1. Чистота хімічних речовин, кваліфікація речовин за чистотою: «чистий» (ч), «чистий для аналізу» (ч.д.а.), «хімічно чистий» (х.ч.), «особливо чистий» (ос.ч.).
2.2. Основні методи очищення і розділення речовин та їх теоретична основа: перекристалізація, дистиляція, возгонка, хімічне осадження, транспортні реакції, екстракція, зонна плавка, йонний обмін, адсорбція.
2.3. Фізичні константи як засіб ідентифікації чистоти речовин: колір, смак, запах, густина, температури плавлення та кипіння, в’язкість, розчинність тощо.
3. Теоретичний матеріал:
Хімічними реактивами називають речовини, які використовують для проведення хімічних реакцій і застосовують для аналізу і синтезу речовин.
Хімічні реактиви в залежності від ступеня чистоти класифікують на технічні (т.), чисті (ч.), чисті для аналізу (ч.д.а.), хімічно чисті (х.ч.), високоеталонно чисті (в.е.ч.), особливо чисті (ос.ч.). Кількість домішок регламентується Держстандартами (ДСТ), технічними умовами (ТУ) або статтями Державної Фармакопеї (ДФ). Звичайно, у практиці хімічного аналізу використовують реактиви кваліфікації ч.д.а. і х.ч.
У лабораторії використовують розчини хімічних реактивів певної концентрації (найчастіше 0,1–0,2 М), рідше — індикаторні папірці. Для розчинення використовують дистильовану воду або органічні розчинники.
При роботі напівмікрометодом використовують реактиви масою від 0,01 до 0,10 г твердої речовини і об’ємом від 0,5 до 5,0 см3 розчину.
4. Література:
4.1. Конспект лекції.
4.2. Сухомлинов А.К., Боровская Н.В., Пустовар П.Я. и др. Неорганическая химия (практикум), 1983, с 5–31.
4.3. Практикум по неорганической химии, под ред. Н.А. Остапкевича, 1987, с. 4–13.
4.4. Практикум загальної та неорганічної хімії. Є.Я.Лівітін та ін. — Х.: „Основа”, 1998р. с. 8–11
5. Завдання для закріплення матеріалу:
5.1. Зробити короткий конспект–характеристику методів розділення і очищення речовин.
Перекристалізація — ________________________________________________________
________________________________________
Дистиляція — _____________________________________________________________
________________________________________
Возгонка — _______________________________________________________________
________________________________________
Хімічне осадження — _______________________________________________________
________________________________________
Транспортні реакції — _______________________________________________________
________________________________________
Екстракція — _____________________________________________________________
________________________________________
Зонна плавка — ____________________________________________________________
________________________________________
Йонний обмін —___________________________________________________________
________________________________________
Адсорбція — ______________________________________________________________
________________________________________
 5.2. Коротко описати методику встановлення температур плавлення і кипіння речовин.
5.2. Коротко описати методику встановлення температур плавлення і кипіння речовин.
Найпростіший прилад для визначення температури плавлення:
1 — гумова пробка з розрізом;
2 — термометр;
4 — посудина з маслом;
3–5 — резервуар для термометра з капіляром (пробірка);
6 — подача газу до пальника;
7— металева (або азбестова) сітка;
8 — капіляр із речовиною;
9 — кільце із пластику чи гуми для кріплення капіляра до термометра;
10 — кільце штативу, який утримує посудину з нагрітим маслом
________________________________________
________________________________________
________________________________________
________
Лабораторна робота.
Дослід 1. Очищення водопровідної води методом дистиляції (перегонки) і встановлення температури її кипіння.
Зібрати прилад для перегонки, налити в колбу Вюрца водопровідної води 1/2 об’єму колби, підвести воду в холодильник і ввімкнути нагрівальний прилад. Після того, як вода закипить, відмітити по термометру температуру кипіння. Декілька крапель дистиляту випарувати на чистому склі. Те ж зробити з водопровідною водою і зробити висновки про наявність солей в дистильованій і звичайній воді. Підписати елементи лабораторної установки для перегонки.
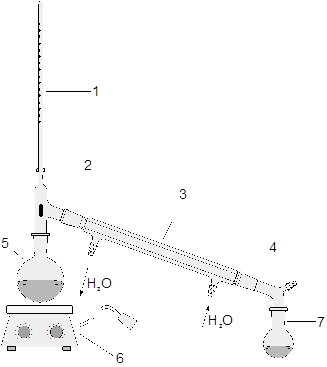 | |||
 | |||
1. _____________________________
2. _____________________________
3. _____________________________
4. _____________________________
5. _____________________________
6. _____________________________
7. _____________________________
Висновок: _________________________________
Дослід 2. Очищення речовин возгонкою.
Зважити 0,2 г речовини (хлориду амонію або йоду), помістити на дно хімічного стакану. Накрити стакан чашкою для випарування або часовим склом з холодною водою і нагріти на електроплитці. Кристали зібрати, розрахувати вихід чистої речовини (в %).
Висновок: _________________________________
Дослід 3. Очищення речовин перекристалізацією.
По вказівці викладача взяти речовину для очищення, розрахувати необхідну кількість води, щоб після перекристалізації отримати 2 г чистої речовини. Воду нагріти до кипіння і розчинити речовину. Гарячий розчин профільтрувати через складчастий фільтр і охолодити. Кристали, що випали в осад, відфільтрувати через воронку Бюхнера, висушити, зважити і розрахувати вихід чистої речовини (в %), встановити температуру плавлення.
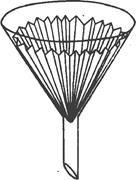
|    
| |
| Конічна лійка зі складчатим фільтром | Прилад для фільтрування під вакуумом: 1.__________________ 2.__________________ |
Висновок: _________________________
„Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Основні класи неорганічних сполук
1. Значення теми: Представники основних класів неорганічних сполук широко застосовуються в медицині як лікарські препарати і хімічні реактиви. Вивчення і знання хімічних властивостей має суттєве значення для подальшого можливого застосування їх з лікувальною метою.
2. Основні питання теми:
2.1. Прості речовини: метали і неметали.
2.2. Складні речовини: бінарні, потрійні, комплексні.
2.3. Оксиди: прості, подвійні, полімерні. Пероксиди та надпероксиди. Номенклатура. Застосування.
2.4. Гідрооксиди: основні, кислотні, амфотерні. Номенклатура. Застосування.
2.5. Кислоти. Орто–, мета–, та полі–форми кислот. Застосування.
2.6. Солі. Класифікація. Номенклатура. Застосування.
2.7. Залежність кислотно–основних форм та властивостей оксидів і гідрооксидів від положення елементів, що їх утворюють у періодичній системі елементів Д. І. Менделєєва.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор.99–125.
3.3. Глинка Н.Л. Общая химия. Л.: 1986. с. 37–43.
3.4. Оленин С.С. Фадеев Г.Н. Неорганическая химия. М.: 1979. с. 126–129.
3.5. Григор’єва В.В. та ін. Загальна хімія. 1991. с.140–164.
3.6. Общая химия в формулах, определениях, схемах. И.Е. Шиманович, М.Л. Павлович, В.Ф. Тыкавий, П.М. Малашко. 1987. 13–30.
4. Завдання для закріплення матеріалу:
4.1. Навести приклади оксидів: а) кислотних; б) основних; в) амфотерних; г) індиферентних.
________________________________________
4.2. Дати міжнародну назву таким речовинам:
а) кислотам: H2SO4, H3BO3, H2SO3, H2S.
б) основам: Fe(OH)3, Fe(OH)2, Cr(OH)3.
в) оксидам: N2O, NO, Mn2O7, N2O3.
г) солям: Al2(SO4)3, FeOHCl2, NaH2PO4, Ca(HCO3)2.
________________________________________________
________________________________________________
________________________________
4.3. Закінчити рівняння реакцій:
K2O + ZnO =___________________________________________________________
CaO + Cl2O7 =__________________________________________________________
Ca(H2РO4)2 + Al2(SO4)3 =__________________________________________________
4.4. Написати рівняння дисоціації таких електролітів: H2SO4, Al2(SO4)3, K2H2P2O7, Cr(OH)2Cl.
________________________________________
4.5. Скласти рівняння реакцій за допомогою яких можна зробити такі перетворення:
а) Ba g BaO g BaCl2 g Ba3(PO4)2 g BaSO4;
________________________________________
б) Zn g K2ZnO2 g ZnCl2 g Zn(OH)2 g Na2[Zn(OH)4] g ZnSO4
________________________________________
в) C g CO g CO2 g Na2CO3 g NaHCO3 g Na2CO3 g CaCO3 g Ca(HCO3)2 g CaCO3.
________________________________________________
________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Основні закони хімії. Закон еквівалентів. Визначення еквівалентної маси металу методом витіснення
1. Значення теми: Знання і володіння основними законами хімії дасть можливість студентам–провізорам зрозуміти і оволодіти кількісними методами дослідження хімічних реакцій, робити стехіометричні розрахунки вагових і об’ємних співвідношень між реагуючими речовинами, розрахунки за хімічними формулами і рівняннями, виводити формули речовин і рівняння реакцій, що знадобиться для вивчення наступних дисциплін та в практичній діяльності.
2. Основні питання теми:
2.1. Закон збереження маси та енергії як кількісне відображення постійності руху матерії.
2.2. Закон сталості складу та його сучасне трактування.
2.3. Закон кратних співвідношень.
2.4. Закон Авогадро та його наслідки.
2.5. Застосування рівняння стану ідеальних газів Клапейрона–Менделєєва для визначення молекулярних мас речовин.
2.6. Еквівалент та еквівалентна маса елементів та простих і складних речовин. Еквівалентний об’єм.
2.7. Еквівалент та еквівалентна маса простих та складних речовин в умовах хімічної реакції. Закон еквівалентів.
2.8. Еквівалент та еквівалентна маса окисника та відновника.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 4–14.
3.3. Сухомлинов А.К., Боровская Н.В., Пустовар П.Я. и др. Неорганическая химия (практикум), 1983, с. 31–42.
3.4. Григор’єва В.В. та ін. Загальна хімія, 1991 с.7–18.
3.5. Глинка Н.Л. Общая химия, 1983, с. 14–35
4. Завдання для закріплення матеріалу:
4.1. За нормальних умов 500 мл газу важить 1,806 г. Знайти його густину за повітрям і молярну масу.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.2. 0,111 г газу займає об’єм 25 мл при 17° С і 101,463 кПа. Розрахувати молярну масу газу.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.3. Розрахувати еквівалентну масу CaO, H3PO4, Ba(OH)2, Al2(SO4)3.
________________________________________________________________
4.4. 1,6 г кальцію і 2,65 г цинку витіснили із кислоти однакову кількість водню. Знайти еквівалент цинку, коли еквівалент кальцію дорівнює 20.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.5. Розрахувати еквівалентну масу KMnO4 як окисника, який в кислому середовищі перетворюється на сіль марганцю(ІІ)?
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
Лабораторна робота.
 Визначення еквівалентної маси металу методом витіснення.
Визначення еквівалентної маси металу методом витіснення.
Метод заснований на реакції розчинення металу в надлишку кислоти і вимірюванні об’єму водню, що виділиться.
Прилад для встановлення еквіваленту металу складається із бюретки 1 та скляної трубки 2, заповнених дистильованою водою і з’єднаних між собою гумовою трубкою. До бюретки приєднана пробірка Оствальда 3. Трубки закріплені зажимами у штативі.
В одне з колін пробірки Оствальда розмістити наважку металу, а в саму пробірку налити 3–5мл HCl. Перевірити герметичність приладу. Для цього приєднати пробірку до бюретки і, не перевертаючи її, опустити або підняти скляну трубку 2.
Коли прилад герметичний, то рівень води в бюретці не повинен змінюватись. Записати в зошит положення рівня рідини в бюретці, атмосферний тиск і температуру.
Після того, як досягнуто герметичності, пробірку перевернути так, щоб метал занурився у HCl. Під тиском водню, який утворюється при взаємодії металу з кислотою, вода із бюретки переходить у трубку 2.
Після закінчення реакції пробірку охолодити до кімнатної температури, а положення менісків в бюретці і трубці привести до одного рівня. Записати нове положення рівня води. Результати вимірів занести до таблиці:
| Наважка, г m(Me) | Умови досліду | Положення рівня рідини | Об’єм витісне–ного водню, мл V | ||
| температура, оС t | тиск, Па Р | до досліду | після досліду | ||
Розрахунки еквівалента:
1. Користуючись формулою  , знайти об’єм водню за н.у. (Vo).
, знайти об’єм водню за н.у. (Vo).
В експерименті водень збирається над поверхнею води і, таким чином, містить водяний пар. Загальний тиск газу в бюретці, який дорівнює атмосферному, складається із тиску водню і водяного пару ( ). З урахуванням цього об’єм водню за нормальних умов встановлюється за рівнянням:
). З урахуванням цього об’єм водню за нормальних умов встановлюється за рівнянням:
 =
=
2. Розраховують еквівалент металу за формулою:
 =
=
Отримане значення порівняти з теоретичним.
3. Розрахувати відносну похибку досліду:
 =
=
При вірному виконання роботи відносна похибка не повинна перевищувати  5%.
5%.
Висновок: _________________________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Розрахунки за хімічними рівняннями
1. Значення теми: Вміння робити розрахунки за хімічними рівняннями необхідне для вивчення наступних дисциплін органічної, аналітичної, фізичної, колоїдної хімії тощо.
2. Основні питання теми:
2.1. Що показує хімічна формула?
2.2. Структура хімічного рівняння. Що показують стехіометричні коефіцієнти?
2.3. Розрахунки кількостей, мас та об’ємів реагуючих речовин за хімічними рівняннями.
2.4. Поняття про:
— вихід продуктів реакції;
— масова частка (основної речовини; компоненту в суміші; розчиненої речовини в розчині; елементу в складі молекули);
— об’ємна частка;
— густина.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор.4–14.
3.3. Хомченко Г.П. Збірник задач з хімії для вступників до вузів, 1993.
4. Завдання для закріплення матеріалу:
4.1. У стальному балоні об’ємом 5л знаходиться аміак при температурі 22ОС і тиску 620 кПа. Яку масу гідросульфату амонію можна добути, якщо весь аміак пропустити крізь надлишок розчину сірчаної кислоти?
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.2. Суміш водню і хлороводню об’ємом 7л (н.у.) пропустили крізь розчин нітрату срібла, взятий у надлишку, і дістали осад масою 28,7г. Визначити об’ємну частку водню у суміші.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.3. Обчислити масу оксиду вуглецю(IV), який можна добути в результаті взаємодії карбонату кальцію масою 7г з соляною кислотою масою 30г, у якій масова частка хлороводню складає 20%.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
4.4. Знайдіть масу осаду утвореного при взаємодії 34г нітрату срібла і 21г хлориду барію.
 Дано:Розв’язання: _______________________________________________
Дано:Розв’язання: _______________________________________________
_________________________________________________________
_________________________________________________________
_________________________________________________________
 _________________________________________________________
_________________________________________________________
_________________________________________________________
Відповідь:____________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Основні теоретичні положення про будову атома
1. Значення теми: Електронна теорія будови атома пояснила фізичний зміст періодичного закону Д.І.Менделєєва. Знання цієї теми дає можливість студентам знаходити для будь яких елементів валентність, ступені окислення та характеризувати властивості цих елементів.
2. Питання, що підлягають вивченню:
2.1. Планетарна модель атома та її протиріччя. Експериментальні дослідження, що підтверджують складну будову атома. Постулати Бора. Спектри поглинання атомів як джерело інформації про їх будову. Квантовий характер поглинання та випромінювання енергії (Планк).
2.2. Корпускулярно–хвильова двоїстість електрону, рівняння Луї де Бройля, принцип невизначеності Гейзенберга. Характер руху електрона в атомі. Електронна хмара. Атомна орбіталь. Хвильова функція та її обчислення на основі рівняння Шредінгера.
2.3. Квантування енергії в системі мікрочастин. Електронні енергетичні рівні атома. Квантові числа, їх характеристика, значення (головне, орбітальне, форма s, p, d, f — орбіталей, магнітне). Орієнтація атомних орбіталей, спінове квантове число.
2.4. Принципи та правила заповнення атомних орбіталей електронами: принцип найменшої енергії, принцип Паулі, правило Хунда та Клечковського. Електронні та електронно–графічні формули атомів та їх іонів.
2.5. Природна та штучна радіоактивність. Токсична дія радіонуклідів, радіофармацевтичні препарати для лікування та діагностики захворювань.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 15–40.
3.3. Григор’єва та ін. Загальна хімія, К., 1991. с. 21–51
3.4. Глинка Н.Л. Общая химия. — Л.: „Химия”, 1986г. с. 55–109
3.5. Оганесян Э.Т. Неорганическая химия, М., 1984, с. 29–47.
3.6. Ахметов Н.С. Общая неорганическая химия, М., 1988.
3.7. Оленин С.С., Фадеев Г.Н. Неорганическая химия, М., 1979, с. 43–67.
4. Завдання для закріплення матеріалу:
4.1.Написати електронні формули елементів з порядковими номерами 15, 34 і 53, встановити родину, підкреслити валентні електрони і для останніх зобразити електронно–графічні формули в нормальному та збуджених станах, встановити валентність, ступінь окислення та навести приклади сполук з даними ступенями окислення.
______________________________________
____________
4.2. Чому при формуванні електронного шару першими заповнюються s–орбіталі?
_______________________________________________________________
4.3. Що визначає спінове квантове число?
_______________________________________________________________
4.4. Скільки значень має магнітне квантове число, якщо l = 1?
_______________________________________________________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Сучасне тлумачення періодичного закону Д.І.Менделеєва на основі електронної теорії атома
1. Значення теми: Знання періодичного закону та структури періодичної системи має велике значення при вивченні загальної хімії та хімії елементів. Вміння користуватись закономірностями періодичної системи в періодах та в групах дозволить студентам характеризувати властивості елементів та їх сполук.
2. Основні питання теми:
2.1. Формулювання періодичного закону Д.І.Менделєєвим і сучасне формулювання періодичного закону. Закон Мозлі.
2.2. Будова періодичної системи елементів: період, група, підгрупа, s, p, d, f — сімейства елементів.
2.3. Періодичний характер зміни властивостей атомів елементів у газоподібному стані як функція зміни їх електронної будови: атомних радіусів, енергії іонізації, спорідненості до електрону, відносної електронегативності.
2.4. Металічні, неметалічні та окисно–відновні властивості.
2.5. Внутрішня та вторинна періодичність.
2.6. Періодичність хімічних властивостей елементів та їх сполук. Фізичний зміст періодичного закону.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 41–60.
3.3. Григор’єва та ін. Загальна хімія, К., 1991. с. 51–61
3.4. Глинка Н.Л. Общая химия, Л., 1986.
3.5. Оленин С.С., Фадеев Г.Н. Неорганическая химия. М., 1979, с. 40–43
4. Завдання для закріплення матеріалу:
4.1. Використовуючи періодичний закон, передбачте формули сполук фосфору з гідрогеном і оксигеном і дайте загальну характеристику цих сполук.
______________________________________________________________
4.2. Використовуючи періодичний закон, дайте відповіді на такі запитання:
а) який елемент має найбільшу електронегативність: P чи Cl? І чому?
_______________________________________________________________
б) вказати характер наступних оксидів хрому: CrO, Cr2O3, CrO3, і підтвердити відповідними рівняннями реакцій.
______________________________________________________________
в) для елементів ІІ періоду навести формули вищих оксидів і вказати їх характер.
______________________________________________________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Теорія хімічного зв’язку
1. Значення теми: Знання цієї теми дозволять студентам передбачати тип та міцність зв’язків в хімічних сполуках, а також їх реакційну здатність. Ці знання допоможуть студентам краще зрозуміти питання просторової будови та реакційної здатності хімічних сполук при вивченні неорганічної, органічної, біологічної, аналітичної хімії, та інших дисциплін.
2. Основні питання теми:
2.1. Сучасні уявлення про природу хімічного зв’язку. Характеристики зв’язку: енергія, довжина, валентний кут.
2.2. Ковалентний зв’язок. Метод валентних зв’язків (ВЗ). Двоелектронний хімічний зв’язок за Гейтлером–Лондоном (на прикладі утворення Н2).
2.3. Обмінний та донорно–акцепторний механізми утворення ковалентного зв’язку.
2.4. Властивості ковалентного зв’язку: насичуваність, напрямленість, поляризаційна здатність.
2.5. Утворення s та p зв’язків, кратність зв’язку згідно з методом ВЗ.
2.6. Утворення ковалентного зв’язку в збудженому стані атомів. Гібридизація атомних орбіталей та просторова будова молекул.
2.7. Визначення валентності за методом ВЗ.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 61–98.
3.3. Глинка Л.Г. Общая химия. Л.: 1986.
3.4. Оленин С.С., Фадеев Г.Н. Неорганическая химия. М.: 1979. с.68–72, 76–80, 83–85, 91–93.
3.5. Григор’єва В.В. та ін. Загальна хімія, 1991, с. 62–85.
4. Завдання для закріплення матеріалу:
4.1. Встановити вид гібридизації атомних орбіталей, просторову будову та валентний кут в наступних молекул: H2S, PH3, SiCl4, MgCl2, AlCl3.Для вказаних молекул графічно зобразити перекриття атомних орбіталей з утворенням відповідних s–зв’язків.
________________________________________________
4.2. В яких сполуках присутній лише s–зв’язок (відповідь мотивуйте):
а) вуглекислого газу
б) хлороводню
в) кисню
г) фтору
д) водню
_____________________________________________________________
4.3. За наявності яких зв’язків обертання атомів карбону відносно один одного неможливе? Навести приклади.
_______________________________________________________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Будова молекул
1. Значення теми: Знання цієї теми дозволять студентам передбачати тип та міцність зв’язків в хімічних сполуках, а також їх реакційну здатність. Ці знання допоможуть студентам краще зрозуміти питання просторової будови та реакційної здатності хімічних сполук при вивченні неорганічної, органічної, біологічної, аналітичної хімії, та інших дисциплін.
2. Питання, що підлягають вивченню:
2.1. Основні положення методу молекулярних орбіталей (МО). Зв’язувальні, розпушувальні та незв’язувальні молекулярні орбіталі. Їх енергія та форма.
2.2. Енергетичні діаграми молекул які утворені атомами елементів І та ІІ періодів періодичної системи елементів. Кратність зв’язку за методом МО.
2.3. Іонний зв’язок та його властивості: ненасичуваність, ненапрямленість. Будова та властивості сполук з іонним типом зв’язку.
2.4. Металевий зв’язок.
2.5. Міжмолекулярна взаємодія та її природа. Орієнтаційна, індукційна та дисперсійна взаємодія.
2.6. Водневий зв’язок та його типи. Роль водневого зв’язку в біологічних системах.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 61–98.
3.3. Григор’єва В.В. та ін. Загальна хімія. 1991. с. 62–104.
3.4. Глинка Н.Л. Общая химия. — Л.: „Химия”, 1986г.
3.5. Оленин С.С., Фадеев Г.Н. Неорганическая химия. М.: 1979, с. 72–76, 81–82, 86–93.
4. Завдання для закріплення матеріалу:
4.1. Зобразіть енергетичні діаграми наступних молекулах: F2, N2, NO, CO.
________________________________________________________
4.2. На прикладі молекул води покажіть схематично утворення водневого зв’язку. Яка біологічна роль водневого зв’язку?
______________________________________________________________
“Зараховано”
„____”_________________200__р. ______________________
(підпис викладача)
Енергетика та напрямок хімічних реакцій
1. Значення теми: Знання основ хімічної термодинаміки необхідно для розуміння основ енергетики біохімічних і біологічних процесів, які вивчаються біохімією, біофізикою та фізіологією. Вміння розрахувати і практично визначити теплові ефекти хімічних реакцій необхідні для розуміння і визначення енергетичних характеристик біохімічних процесів організму людини.
2. Питання, що підлягають вивченню:
2.1. Предмет хімічної термодинаміки. Характеристика термодинамічних систем та їх стану.
2.2. Перший закон термодинаміки. Поглинання та випромінювання різних видів енергії при хімічних перетвореннях. Внутрішня енергія та ентальпія. Тепловий ефект ізобарного та ізохорного процесів. Термохімічні рівняння, їх особливості.
2.3. Закон Гесса та його наслідки. Стандартні умови та стандартні значення ентальпії утворення та згоряння речовин. Розрахунки теплових ефектів хімічних реакцій, процесів розчинення речовин, дисоціації кислот та основ.
2.4. Другий закон термодинаміки. Ентропія як міра безпорядку системи (рівняння Больцмана).
2.5. Енергія Гібса як критерій самочинного протікання хімічних реакцій та характеристики термодинамічної стійкості хімічних сполук.
2.6. Значення термохімічних розрахунків для енергетичної характеристики біохімічних процесів. Підпорядкованість живих організмів законам термодинаміки.
3. Література:
3.1. Конспект лекції.
3.2. Левітін Є.Я. та ін. Загальна та неорганічна хімія. Підручник. Вінниця: НОВА КНИГА, 2003.— стор. 126–139.
3.3. Григор’єва та ін. Загальна хімія. 1991. с. 104–114
3.4. Глинка Н.Л. Общая химия. — Л.: „Химия”, 1986г. — с. 158–196.
3.5. Садовничая Л.П., Хухрянский В.Г., Циганенко А.Я., Биофизическая химия, 1986, с. 8–29, 35–37.
4. Завдання для закріплення матеріалу:
4.1. При зберіганні пшеничного борошна вуглеводи, що містяться в ньому, повільно окислюються з виділенням тепла. Знайти тепловий ефект реакції, якщо теплоти утворення речовин дорівнюють:
 Ноутв.(CO2) = –393,6 кДж/моль,
Ноутв.(CO2) = –393,6 кДж/моль,
 Ноутв.(H2O) = –285,6 кДж/моль,
Ноутв.(H2O) = –285,6 кДж/моль,
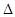 Ноутв.(C6H12O6) = –1272,45 кДж/моль.
Ноутв.(C6H12O6) = –1272,45 кДж/моль.
______________________________________________________________
4.2. Реакція окислення оксиду вуглецю(ІІ) іде за рівнянням:
CO(г.) +  O2(г.)
O2(г.) 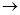 CO2(г.);
CO2(г.); 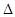 Но = –264,7 кДж.
Но = –264,7 кДж.
Скільки літрів вуглецю(ІІ) треба спалити, щоб утворилось 4,187 кДж теплоти?
______________________________________________________________
4.3. Чи є можливою реакція: NO(г.) +  O2(г.)
O2(г.) 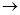 NO2(г.); якщо
NO2(г.); якщо






