ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
В процессе электролиза у электродов происходит разряд катионов и анионов в соответствии с законом Фарадея, а также направленное движение ионов согласно их знакам. Поскольку скорости движения анионов и катионов могут различаться, они будут переносить разные количества электричества. Уяснить смысл этого можно при рассмотрении схемы, приведенной на рисунке 1.
На схеме плюсами обозначены катионы, а минусами – анионы. Пусть те и другие будут одновалентны. Разделим пространство между электродами на три части (катодную – католит, анодную – анолит и среднюю) и рассмотрим, какие изменения произойдут в них при пропускании постоянного тока. Для простоты предположим, что ионы располагаются в виде цепочек (положение А). Допустим, что катионы движутся быстрее анионов точно в три раза, поэтому на один переместившийся анион приходится три переместившихся катиона (положение Б).
После прохождения одного Фарадея электричества (1F) на катоде и аноде произойдет соответственно разряд одного моля эквивалентов анионов и катионов (В). Нетрудно убедиться в том, что различие в скорости движения катионов и анионов не приводит к появлению в катодном и анодном пространствах ячейки избытка ионов какого либо знака.
 |
Рис. 1. Схема перемещения ионов в растворе электролита. Стрелками показано направление движения ионов
На схеме видно, что перенос ионов при принятом соотношении скоростей катионов и анионов приводит к увеличению концентрации электрохимически активного вещества у катода и уменьшению – у анода. Доля тока (ti), переносимая данным видом ионов через раствор, называется числом переноса и определяется уравнением
ti =  , (1)
, (1)
где Ii – ток перенесенный данным видом ионов;
I – общий ток, протекший через систему.
Очевидно, что сумма чисел переноса всех ионов, присутствующих в растворе, равна единице, т.е. 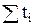 = 1.
= 1.
Числа переноса связаны со скоростями движения соответствующих ионов или ионными подвижностями следующими соотношениями:
t + =  ; t- =
; t- =  , (2)
, (2)
где v+ и v - –скорости движения катиона и аниона, м/с;
λ+ и λ- – ионные подвижности, См·м2/(моль эквивалентов).
Для смесей электролитов число переноса каждого иона зависит также от его концентрации в растворе
ti =  , (3)
, (3)
где zi–заряд i-го иона;
сi– концентрация i-го иона.
В стационарном состоянии устанавливается некоторая постоянная разность концентраций между средней частью раствора, анолитом и католитом. Такое состояние может наступить лишь по истечении длительного времени, но в первое время после начала электролиза изменения концентрации электролита в приэлектродных слоях раствора целиком определяются количеством пропущенного электричества.
При пропускании 1Fэлектричества произойдут следующие концентрационные изменения в катодном пространстве: 1 моль эквивалентов катионов выделится на катоде; t+ молей эквивалентов катионов поступит из анодного отделения; t- молей эквивалентов анионов уйдет в анодное отделение. Убыль катионов в катодном отделении равна (1 – t+) = t- молей эквивалентов.
В целом количество электролита в катодном отделении электролизера уменьшится на t- молей эквивалентов.
В анодном пространстве: 1 моль эквивалентов анионов разрядится; t- моль эквивалентов анионов поступит из катодного отделения; t+ молей эквивалентов катионов перенесется током в катодное отделение. В итоге имеем общую убыль анионов, равную (l – t-) = t+ молей эквивалентов и такую же убыль катионов, т.е. в целом общее содержание электролита в анодном отделении понижается на t+ молей эквивалентов.
Обозначив изменение количества электролита в числах молей эквивалентов возле электродов через Δск для катодного и Δса – анодного отделений электролизера, запишем отношение
 . (4)
. (4)
Найденное отношение дает возможность раздельно определить числа переноса анионов и катионов. Прибавив к обеим частям уравнения (4) по единице, получим:
 или
или 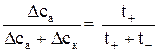 . (5)
. (5)
Но так как t ++ t – = l, последнее равенство можно привести к виду
 . (6)
. (6)
Аналогично для чисел переноса катионов
 . (7)
. (7)
Уравнения (6) и (7) применимы для расчета чисел переноса после аналитического определения изменений концентрации электролита возле электродов, но только для случая нерастворимых электродов и отсутствия участия растворителя в электрохимическом процессе.
Метод определения чисел переноса, основанный на установлении концентрационных изменений возле электродов электрохимической ячейки, называют методом Гитторфа.
Методом Гитторфа определяют кажущиеся числа переноса, так как ионы в водном растворе гидратированы и переносят с собой воду, что не было учтено в приведенных выше расчетах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: определение чисел переноса ионов H+ и SO42- раствора серной кислоты.
Схема установки для определения чисел переноса изображена на рис. 2.
Вместо медного кулонометра можно использовать газовый или любой другой. Одновременное применение миллиамперметра и кулонометра обусловлено тем, что с помощью первого ведется грубое регулирование тока, а по второму определяется точное количество электричества, прошедшего в цепи за время опыта.
Порядок выполнения работы
Опыт проводится в такой последовательности.
1. Готовят раствор серной кислоты заданной преподавателем концентрации в таком количестве, чтобы его хватило на три пробы титрования с аликвотой 4–5 мл и для заливки в ячейку с электролитическим ключом;
2. Кислоту заливают в ячейку с электролитическим ключом и погружают туда свинцовые электроды, таким образом, чтобы уровень электролита был одинаков в обоих сосудах;
3. Одновременно с выполнением п.п. 1 и 2 готовят катод кулонометра, для этого медную платину зачищают до блеска наждачной бумагой, промывают в дистиллированной воде, обезжиривают этиловым спиртом и высушивают на воздухе. После этого катод взвешивают на аналитических весах и значение массы заносят в таблицу.
4. Помещают медный катод в кулонометр.
5. Собирают установку согласно рис. 2 и обращаются к преподавателю для проверки правильности подключения проводов.
6. Включают ток (сила тока указывается инженером) и начинают процесс электролиза. В дальнейшем силу тока стараются сохранить постоянной. Электролиз ведут в течение часа.
7. Устанавливают точное значение концентрации серной кислоты. Для этого оставшийся раствор серной кислоты титруют 0,1N раствором NaOH с метиловым оранжевым в качестве индикатора. Из трех титрований находят среднее значение молей эквивалентов серной кислоты в исходном растворе.
8. После 60 минут электролиза выключают ток и сливают растворы из
катодного и анодного пространств одновременно.
9. Для нахождения концентрации кислоты после опыта выполняют титрование раствора из катодного отделения.
10. Одновременно с выполнением п. 9 извлекают медный катод из кулонометра, промывают в дистиллированной воде, не касаясь руками осадка, высушивают и взвешивают.
Обработка результатов опыта
Зная титр и объем щелочи, использованной на титрование кислоты до и после электролиза, а также общее количество кислоты и общее количество электричества q, протекшее в цепи за время электролиза и измеренное кулонометром, можно рассчитать изменение количества молей эквивалентов кислоты и следовательно количества молей эквивалентов ионов водорода в катодном пространстве.
Изменение молей эквивалентов кислоты в катодном пространстве определяется выражением
Δск =  –
–  , (8)
, (8)
где  – количество молей эквивалентов ионов водорода, восстановившихся при электролизе;
– количество молей эквивалентов ионов водорода, восстановившихся при электролизе;  – количество молей эквивалентов ионов водорода, перешедших из анодного пространства в катодное.
– количество молей эквивалентов ионов водорода, перешедших из анодного пространства в катодное.
Уравнение (8) можно преобразовать к виду
Δск = (N1V1 –N2V2)· 10-3 = 
 . (9)
. (9)
 |
Рис. 2. Схема электрической цепи для измерения чисел переноса.
1 - источник питания; 2 - миллиамперметр; 3- медный кулонометр; 4 - медные аноды; 5 - медный катод; 6 - раствор CuSO4;7 - ячейка с электролитическим ключом; 8 – раствор серной кислоты; 9 – свинцовые электроды;10 – электролитический ключ
Откуда имеем
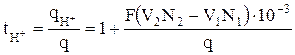 , (10)
, (10)
где N1 и N2 – нормальности раствора до и после электролиза соответственно;
V1 и V2 – объем катодной жидкости до и после электролиза, мл.
Если использован медный кулонометр, то количество пропущенного электричества q (Кл) находят по уравнению
q = 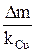 , (11)
, (11)
где Δm – изменение массы катода, г;
kCu =  – электрохимический эквивалент меди, г/Кл,
– электрохимический эквивалент меди, г/Кл,
АCu – атомная масса меди, г/моль.
Определив q и изменение количества кислоты в катодном пространстве в молях эквивалентов Δск, рассчитываем по уравнению (9) число переноса иона водорода, а затем по уравнению  = l –
= l –  – число переноса сульфат-иона. Все экспериментальные данные сводят в таблицу 1.
– число переноса сульфат-иона. Все экспериментальные данные сводят в таблицу 1.
Таблица 1. Экспериментальные и рассчитанные результаты
| Кулонометрические измерения | Концентрация кислоты, моль-эквивалентов/л | Объем кислоты, мл | Число переноса | ||||||
| Масса медного катода, г | Привес катода, г | q, Кл | |||||||
| До электролиза | После электролиза | До электролиза, с1 | После электролиза, с2 | V1 | V2 | Ионов водорода | Сульфат-ионов | ||
По результатам работы делают выводы и вычисляют абсолютную и относительную ошибки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие факторы влияют на числа переноса?
2. Напишите уравнение связи чисел переноса ионов с их подвижностями
3. Дать определение числа переноса. Написать уравнение связи между числом переноса и скоростью движения ионов или ионными подвижностями для раствора одного электролита.
4. Дать определение числа переноса. Написать уравнение связи между числом переноса иона и скоростью движения ионов или ионными подвижностями для смесей электролитов.
5. Выразить числа переноса катионов и анионов согласно закону Гитторфа.
6. Назначение кулонометра. На каком законе основана работа кулонометра?
7. Показать, как использовался кулонометр в работе и последующие расчеты.
8. Рассказать, как рассчитывали числа переноса в работе. Обосновать метод расчета.
9. Как определить числа переноса в случае растворимых электродов?
10. Способы установления чисел переноса. Рассказать сущность методов.
11. Понятие кажущих и истинных чисел переноса. В чем различие между ними. Какие числа переноса больше?
12. Нарисовать электрическую схему установки для измерения чисел переноса в работе.
13. Написать схемы электрохимических цепей кулонометра и используемой в работе для измерения чисел переноса.
14. Законы Фарадея.
15. Как рассчитать электрохимический эквивалент?
16. Какие равновесия устанавливаются на катоде и аноде кулонометра?
17. Уравнение Нернста для потенциала электродов в кулонометре в равновесии.
18. Реакции на катоде и аноде в кулонометре при пропускании тока.
19. Размерности величин в уравнениях.
РАБОТА 3






