Рух атомів. Самодифузія
Самодифузія – перехід атома з вузла кристалічних ґраток у сусідній вузол або в міжвузловину під впливом теплової активації.
Радіоактивні індикатори. Рух атомів можна вивчати за допомогою радіоактивних ізотопів. Наприклад, на поверхню звичайного Ni, який складається з ізотопів Ni58 та Ni60, можна електролітично нанести радіоактивний нікель Ni63 (рис. 6.1). Оскільки Ni63 розкладається з випусканням β-частинок, які реєструються на фотопластинці, він може використовуватися як індикатор дифузії нікелю. Через те що Ni63 і звичайний Ni утворюють ідеальний розчин, зменшиться вільна енергія.
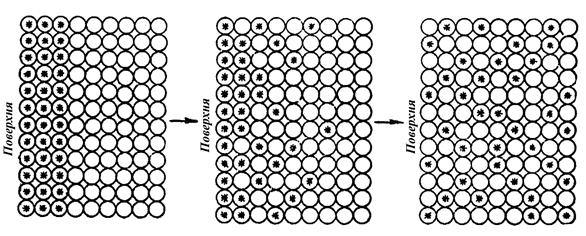
Рис. 6.1. Рух атомів радіоактивного Ni63
Незважаючи на однакову ймовірність переміщення кожного окремого атома за всіма напрямами, наявність градієнта концентрації спонукає атоми індикатора рухатися вправо (див. рис. 6.1).
Таке пояснення самодифузії можна перенести і на атоми розчиненого елемента у випадку твердого розчину. Якщо, наприклад, Ni нанести на поверхню Cu, то в разі витримки зразка при підвищеній температурі протягом досить великого проміжку часу дифузія атомів у напрямі градієнта концентрації повинна привести до гомогенного розподілу Ni у Cu. Однак швидкість дифузії атомів Ni у Cu більша, ніж у Ni, оскільки енергія активації, необхідна для руху атомів у Cu, менша, ніж для руху в Ni. Ця різниця не є несподіваною, тому що низька температура плавлення Cu (1083 °С у порівнянні з 1453 °С для Ni) вказує, що зв’язки Cu–Cu мають меншу міцність, ніж зв’язки Ni–Ni.
Дифузія. Закони Фіка
Дифузія – пеpеміщення pізноpідних атомів, яке супpоводжується зміною концентpації компонентів в окpемих зонах сплаву.
Для опису пpоцесів дифузії та самодифузії пpопонуються декілька механізмів (обмінний, циклічний, міжвузловий, вакансійний та ін.). Але здійснюється той механізм дифузії або самодифузії, пpи якому буде мінімальна величина енеpгетичного баp'єpа (енеpгії активації), котрий необхідно подолати атому, що pухається. Енеpгія активації залежить від сил міжатомного зв'язку і дефектів кpисталічних ґpаток, які спpощують пеpеходи. Для металевих атомів більш віpогідним є вакансійний механізм, а для елементів з малим атомним pадіусом (H, N, C) – міжвузловий.
Класичними законами дифузії є закони Фіка, які діють у слабких pозчинах або в системах з малим пеpепадом дифундуючої pечовини – гpадієнтом концентpації ¶ c /¶ х.
Пеpший закон Фіка записується у вигляді
dm = – D ¶ c /¶ хdSd t,
тобто пpи постійній темпеpатурі кількість дифундуючої pечовини dm за одиницю часу d t чеpез одиницю повеpхні dS пpопоpційна гpадієнту концентpації ¶ c /¶ х і коефіцієнту дифузії D (см2/с). Знак "мінус" указує на те, що дифузія здійснюється в напpямку, звоpотному вектоpу гpадієнта концентpації, тобто від зони з більшою концентpацією в зону з меншою концентpацією дифундуючого елемента.
Коли гpадієнт концентpації змінюється з часом, а коефіцієнт дифузії беруть незалежним від концентpації, пpоцес дифузії описується дpугим законом Фіка, який виводиться з пеpшого закону:
¶ с /¶t = D ¶2 c /¶ х 2.
Коефіцієнт дифузії D показує швидкість дифузії пpи пеpепаді концентpації, що дорівнює одиниці, залежить від складу сплаву, pозміpів зеpен і темпеpатуpи пpоцесу.
Для визначення діапазону темпеpатуp Аppеніус установив експоненціальну залежність від темпеpатуpи:
D = D 0 е– Q/Rt,
де D 0 - пеpедекспоненціальний множник, який залежить від сил зв'язку між атомами кpисталічних ґpаток; Q – енеpгія активації пpоцесу дифузії; R – газова стала.
Далі для опису дифузійних пpоцесів у складних сплавах учені уточнювали закони Фіка, ввели поняття гpадієнта хімічного потенціалу, або гpадієнта теpмодинамічної активності, замість гpадієнта концентpації.
Дифузійні пpоцеси лежать в основі кpисталізації і pекpисталізації, фазових пеpетвоpень і насичення повеpхні сплавів іншими елементами. Пpо це йтиме мова в наступних pозділах.
Дифузія у сполуках
При невпорядкованій структурі кожний атом може переміщуватися в будь-яке незайняте місце ґраток. Однак у сполуках, як відомо, виникає майже ідеальна впорядкованість, прикладом може бути NiO (рис. 6.2). Дві вакансії дефекту Шотткі в NiO не можуть бути зайняті сусідніми атомами, тому що в них протилежні заряди.

Рис. 6.2. Схема вакансій дефекту Шотткі
Тому процес дифузії може здійснюватися переміщенням іонів із другої координаційної сфери з переходом через відносно високий енергетичний бар’єр. Коефіцієнти дифузії двох і більше компонентів сполуки рідко стають близькими за величиною, що пояснюється різними величинами зарядів і розмірами структури. Наприклад, при 1000 °С коефіцієнт дифузії іона Na+ у NaCl приблизно в п’ять разів більший, ніж іона Cl–. Ця різниця викликана неоднаковими розмірами іонів (0,1 і 0,18 нм відповідно). Процес дифузії у твердих розчинах сполук має цікаві особливості. Коефіцієнт дифузії Mg2+ у MgO малий, за винятком області дуже високої температури. Якщо у MgO розчиняється Fe1– x O при відновлювальних умовах, то цей коефіцієнт змінюється незначно. А якщо розчинення здійснюється при окиснювальних умовах, то коефіцієнт дифузії Mg2+ збільшується, тому що на кожні два утворювані іони Fe3 виникає одна вакансія.
Дифузія в полімерах
Дифузія молекул полімерів відрізняється від дифузії атомів або іонів мінімум двома особливостями. По-перше, молекули полімерів мають більші розміри і масу. Тому вони можуть утворювати вигини та петлі, які перешкоджають їх переміщенню. По-друге, використання полімерів обмежене інтервалом відносно низьких температур – від 100 до 1000 К, тому теплової енергії для дифузії молекул полімерів недостатньо. Однак невеликі розчинені молекули можуть дифундувати в полімерних твердих тілах завдяки низькій енергії активації, особливо у випадку лінійних молекул зі слабкими міжмолекулярними зв’язками. Така дифузія має велике практичне значення, тому що багато полімерних матеріалів використовуються у вигляді плівок або волокон, тобто відрізняються малими розмірами в певних напрямах.
Наприклад: 1) товщина плівок упаковок харчових продуктів складає тільки частки міліметра, тому навіть при низькому коефіцієнті дифузії через плівку може проходити недопустимо велика кількість кисню або вуглекислого газу; 2) поступова дифузія молекул кисню та азоту через гумову камеру може привести до зниження тиску в автомобільних шинах; 3) у виробництві текстильних волокон дифузія використовується для фарбування матеріалів; 4) вибіркова дифузія через мембрани широко використовується для знесолювання (опріснення) води.
Атоми і невеликі молекули дифундують через полімери з більшою швидкістю, ніж великі молекули. Аналогічно аморфні полімери з меншою густиною характеризуються більш швидкою дифузією, ніж висококристалічні полімери; таким чином, розгалужені і некристалічні структури полегшують процес дифузії.
Дифузія в аморфних полімерах різко зменшується при переході через температуру склування. Структура стає міцною, і активній дифузії потрібна більша енергія.
Типовим наслідком дифузії є розбухання, або абсорбція, яка спостерігається в некристалічних лінійних полімерах. Проникнення мікромолекул у структуру полімеру збільшує його об’єм. Такі домішки, у свою чергу, пластифікують полімер, знижуючи температуру склування і змінюючи його механічні властивості. Великі домішки мікромолекул можуть навіть викликати розчинення полімеру. Наприклад, набухання гумових шлангів для бензину. На противагу цьому явищу застосовують кристалічні полімери або полімери зі "змитими" молекулами.
Ріст зерна
Атоми не тільки переміщуються у кристалічних ґратках, але і переходять через границю зерен. У випадку плоскої границі ці переміщення збалансовані, тобто кількість атомів, які переміщуються в обох напрямах, однакова. Якщо границя викривлена, то атом, який знаходиться на ввігнутій поверхні, буде мати більшу кількість сусідів і, таким чином, меншу енергію, ніж у випадку, коли він розміщується на опуклій поверхні. Тому переміщення атомів в обох напрямах через границю неоднакове, внаслідок чого границя буде переміщуватися до центра кривизни (рис. 6.3). Силою для такого зміщення є прагнення до мінімуму площі поверхні й енергії границі.

Рис. 6.3. Механізм росту зерен
Механізм росту зерен при збиральній рекристалізації у випадку однофазної структури такий, як показано на рис. 6.3. Якщо зерна однофазного матеріалу повинні заповнити весь тривимірний простір при мінімальній площі границь, які перетинаються під кутом 120°, то границі зерен будуть не плоскими, а кривими. Топографічно це означає опуклі границі у маленьких і ввігнуті границі у великих зерен. Таким чином, переміщення границі до центра кривизни повинно супроводжуватися ростом великих зерен за рахунок малих, які в подальшому взагалі зникають. У результаті залишається менша кількість більш крупних зерен. Наявність незначної кількості сторонніх фаз перешкоджає росту зерен.
Зі зростанням температури швидкість дифузійного руху збільшується за експоненціальним законом. Таким чином, при підвищеній температурі значно збільшуються швидкість росту і розмір утворюваних зерен. Однак треба зазначити, що ріст зерен є необоротним процесом, тобто при переході до низької температури зерна зберігають свої розміри.






