Выполнил:
студент гр. ИСГ-111
Нурыев С.Д
Проверил:
Забелина О.Н.
Владимир 2012
Цель работы: исследование образца кислотных осадков.
Оборудование и реактивы: бюретка на 25 мл, мерный цилиндр на 25 мл; колбы конические на 250 мл – 3 шт; химический стакан и воронка; раствор КОН; индикатор фенолфталеин.
Теоретическая часть
Кислотными называются любые осадки – дожди, туманы, снег, кислотность которых выше нормальной. К ним также относят выпадение из атмосферы сухих кислых частиц, более узко называемых кислотными отложениями.
Кислотные осадки обусловлены присутствием серной (Н2SО4) и азотной (НNО3) кислот. Обычно кислотность на две трети состоит из первой и на одну треть из второй, но во многом их соотношение определяется особенностями антропогенного загрязнения атмосферы в конкретном регионе. Присутствие в этих формулах серы и азота указывает на то, что проблема связана с выбросами данных элементов в воздух.
Загрязнение атмосферы соединениями серы. Соединения серы попадают в атмосферу, как естественным путем, так и в результате антропогенной деятельности. При отсутствии источников загрязнения диоксид серы (SO2) встречается в атмосфере в виде ничтожных следов. Единственным крупным естественным источником диоксида серы является вулканическая деятельность. В основном SO2 поступает в атмосферу в результате человеческой деятельности. Главная причина загрязнения им атмосферы - сжигание ископаемого топлива, которое содержит серу. В процессе горения часть серы окисляется до SO2. Но основной вред окружающей среде наносит не диоксид серы, а продукт его окисления SО3. Процесс окисления осуществляется под действием кислорода на пылеобразных частицах оксидов металлов в качестве катализаторов, в атмосферной влаге или под действием солнечного света. Газообразный SОз растворяется в капельках влаги с образованием серной кислоты:
SОз(газ) +Н20(ж) = Н2S04(водн)
Загрязнение атмосферы соединениями азота. Оксиды азота образуются в атмосфере как естественным, так и антропогенным путем при горении ископаемого топлива. Загрязнение атмосферы оксидами азота в целом сравнительно невелико. Однако в районах с развитой химической промышленностью имеются локальные зоны повышенного содержания N0, N02 в воздухе. Основными антропогенными источниками поступления оксидов азота в атмосферу является сжигание всех видов природного топлива (12 млн.т./год), транспорт (8 млн.т./год) и промышленность (1 млн.т./год).
Монооксид азота NО образуется в малых количествах в цилиндрах двигателей внутреннего сгорания при прямом взаимодействии кислорода с азотом. Одним из важных свойств NО является его способность реагировать с кислородом с образованием NО2:
2NО (г) + О2 = 2 N02
Вследствие этой реакции некоторое количество диоксида азота присутствует в выхлопных газах двигателей внутреннего сгорания. Газообразный диоксид азота растворяется в капельках влаги с образованием азотной кислоты:
ЗN02 + Н20 = 2НN03 + N0
Вымывая из атмосферы Н2S04 и НNО3, осадки становятся кислотными. Их рН зависит от количества как кислот, так и воды, в которой они растворены. Сильные дожди обычно менее кислотные. У туманов рН может упасть ниже всего, поскольку здесь кислоты растворены в относительно меньшем количестве влаги. Мерой кислотности воды является концентрация ионов водорода [Н+], выраженная в моль/л. Молекула воды слабо диссоциирует с образованием ионов водорода Н+ и гидроксид- ионов ОН-
Н2О «Н+ + ОН-.
В пробе чистой воды концентрации [Н+ ] и [ОН-] равны между собой и эти величины при 25 0 С составляют 10-7 моль/л. Растворы с одинаковыми концентрациями ионов водорода и гидроксид-ионов называются нейтральными:
[Н+] = [ОН-] = 10-7 моль/л.
Обычно кислотность раствора выражают другим способом. Вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Эта величина называется водородный показатель и обозначается рН
рН=-lg[Н+].
Так как -lg 10-7 = 7, значит, рН=7 характеризует нейтральные растворы.
В кислой среде концентрация [Н+] больше [ОН-], а в щелочных, наоборот, концентрация гидроксид-ионов больше, чем ионов водорода:
[H+] > [OH-], [H+] > 10-7, pH< 7 - кислая среда
[H+] < [OH-], [H+] < 10-7, pH > 7 - щелочная среда.
Чистая дождевая вода не является нейтральной. В отсутствие любых загрязнителей у дождевой воды обычно слабокислая реакция (рН=5,6), поскольку в ней легко растворяется углекислый газ из воздуха с образованием слабой угольной кислоты:
СО2 + Н2О = Н2СО3.
Таким образом, кислотными точнее называть осадки с рН 5,5 и ниже.
Ход работы
В коническую колбу мерным цилиндром отбираем 25 мл кислотных осадков определенного образца. В бюретку, закрепленную в штативе, наливаем титрант КОН и доводим его объем до нулевой отметки, предварительно заполнив носик бюретки. В каждую колбу добавляем 4–5 капель индикатора фенолфталеина и титруем раствором КОН до перехода окраски от бесцветной к слабо–розовой, не исчезающей в течение 20 сек. Повторяем опыт несколько раз, записывая значения объёма VН+ для каждого опыта, находим среднее значение этого объёма.
V 1 = 10,20 мл – промах титрования;
V 2 = 12,45 мл
V 3 = 12,35 мл
V 4 = 12,55 мл
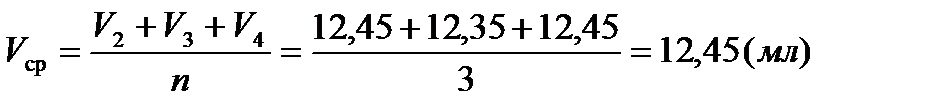
Полученный результат подставляем в формулу, рассчитывая значение концентрации [Н+] :
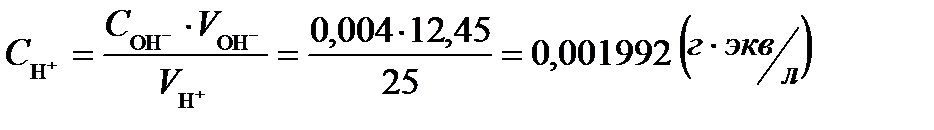
Вычисляем значение рН по формуле:
рН = – lg СН+ = lg 0,001992 ≈ 2,70
Вывод: исследуемый раствор имеет рН = 2,7. Следовательно, этот раствор является кислотным осадком, так как рН < 5,6.






