
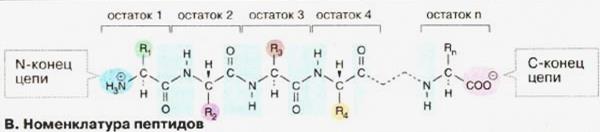
Первинна структура молекули білка визначається кількістю та послідовністю амінокислотних залишків у ній, які з’єднані між собою пептидними зв’язками.

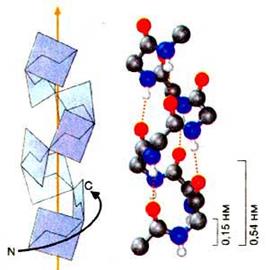
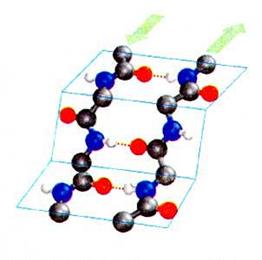
Вторинна структура молекули білка формується за рахунок водневого зв’язку між групами –NH – i –CO – даного поліпептидного ланцюга, що приводить до упорядкування розміщення в просторі поліпептидного ланцюга у вигляді спіральної (α-спіраль) або складчастої структури (β-структура).

| 
|
| α-спіраль | β-структура |
Третинна структура молекули білка утворюється внаслідок взаємодії між боковими відгалуженнями поліпептидних ланцюгів. Це призводить до формування водневих, дисульфід них, іонних (сольових), вандерваальсових та інших зв’язків. Поліпептидні ланцюги згортаються в певному порядку, що призводить до утворення просторової конфігурації білкової молекули. При цьому гідрофобні радикали «втягуються» всередину молекули, а гідрофільні орієнтуються в бік розчинника, створюючи енергетично вигідну конфігурацію білкової молекули.

Четвертинна структура білкової молекули є асоціацією декількох субодиниць поліпептидної природи, мають первинну, вторинну і третинну структури, або глобул, що сполучені у єдину складну молекулу. Окремі субодиниці називаються протомери, а їх комплекс – мультимер. Кількість протомерів – різна: від 4 у гемоглобіні до кількох тисяч у білка тютюнової мозаїки.

| 
|
| Гемоглобін | Самоукладання вірусу табачної мозаїки |
Структура молекули білка дуже лабільна й легко змінюється під впливом різних факторів, що приводить до зміни їх нативних властивостей – фізичних, фізико-хімічних і біологічних властивостей.
Фактори, що впливають на зміну структури і стану білків:
t температура;
t механічний вплив (струшування, збивання);
t дія лугів, кислот;
t дегідратація при сушінні або заморожуванні.
Хімічні властивості білків
Білки є амфотерними сполуками, їх властивості визначаються наявністю в складі їх макромолекул різних функціональних груп, здатних до іонізації в водних розчинах (карбоксильна і гідроксильна групи). Ступінь іонізації функціональних груп залежить від значення рН середовища. В кислому середовищі пригнічується дисоціація карбоксильних груп, і молекула набуває сумарного позитивного заряду – білок виявляє властивості катіону (переважають позитивно заряджені іони) – реагує як основа, а у лужному середовищі пригнічується іонізація аміногруп, і білок набуває сумарного негативного заряду, виявляє властивості аніону – реагує як кислота.
Білки можуть мати:
· кислотний характер (складаються переважно із залишків 2-х основних кислот);
· лужний характер (в їх складі більшість аміногруп);
· нейтральний характер (однакова кількість карбоксильних і аміногруп в їх молекулі).
Залежно від знака заряду молекула білка в електричному полі переміщується відповідно до катода або анода. При певному значенні рН середовища кількість позитивно і негативно заряджених груп у складі молекули білка урівноважується, тобто молекула стає електронейтральною.
Значення рН середовища, при якому молекула білка містить однакову кількість позитивно і негативно заряджених груп, називається ізоелектричною точкою білка.
Ізоелектрична точка білка характеризується:
ü найменшою розчинністю білка і випадінню його в осад при додаванні водовідбірних агентів (внаслідок втрати заряду молекули);
ü втратою здатності рухатися в електричному полі до позитивно або негативно зарядженого полюсів.
1. Реакції осадження спрямовано на виділення білків з розчинів за допомогою різних осаджувачів, під дією яких зменшується або зникає заряд колоїдної частинки (міцели) та руйнується гідратна оболонка білкової частинки. Вони зближуються, з’єднуються між собою і випадають в осад.
Розрізняють два види осадження:
8 висолювання ‑ це осадження білків концентрованими розчинами нейтральних солей (при збільшенні іонної сили розчину). Належить до оборотних реакцій осадження, так як білкові молекули не зазнають глибоких змін і після додавання розчинника їх фізико-хімічні властивості повністю відновлюються. Наприклад, осадження білків органічними розчинниками (етанолом або ацетоном) і висолювання білків нейтральними солями (NaCI, NH4CI, (NH2)2SO4).
8 денатурація ‑ зміна нативної структури білкової молекули під впливом зовнішніх факторів. Належить до необоротного осадження (згортання, денатурація). Після необоротного осадження білок не можна знову перевести у розчин. Найбільшу схильність осаджуватися білок виявляє в ІЕТ.

| Денатурація білка (руйнуються вторинна, третинна, четвертинна структури білка, білок втрачає свої природні властивості, зникають гідратна оболонка, заряд частинки і здатність розчинятися). |
Денатурація білків відбувається при дії:
Ø фізичних факторів: високий тиск, температура, ультразвук, іонізуюче випромінювання, збивання, струшування;
Ø хімічних факторів: зміна рН середовища, органічні та неорганічні кислоти, луги, солі важких металів.
Ознаки денатурації (зміни властивостей білків):
ü зниження гідрофільності і розчинності білків;
ü збільшення в’язкості розчинів – білки втрачають здатність до кристалізації;
ü зміна молекулярної маси, форми і конформації молекул білка
ü білки краще піддаються впливу протеолітичних ферментів, покращується процес засвоєння їжі;
ü підвищення реакційної здатності (відкриття хімічно-активних груп, що були заховані в середині білкової молекули);
ü відбувається агрегація (укрупнення) білкових молекул.
2. Кольорові реакції білків (встановлюють присутність білків, а в їх молекулах – певних угруповань).
· біуретова реакція (реакція на пептидні зв’язки);
Лужний розчин білка + Сu2+ → фіолетове забарвлення, що зумовлене виникненням купрумового комплексу білкової молекули.
· ксантопротеїнова реакція (реакція на циклічні й ароматичні амінокислоти);
Розчин білка + HNO3 → жовте забарвлення (при нагріванні) внаслідок нітрування залишків ароматичних амінокислот білкової молекули та утворення полі нітросполук жовтого кольору.
При додаванні до такої суміші концентрованого розчину аміаку жовтий колір поступово переходить у оранжевий – утворюються аніони більш інтенсивно забарвлені.
Реакція свідчить про наявність у молекулах білка ароматичних ядер фенілаланіну, тирозину і триптофану.
· сульфгідрильна реакція (реакція на сірковмісні амінокислоти);
Розчин білка + розчин (CH3COO)2Pb → випадіння чорного осаду PbS (при кип’ятінні розчину білка з 30%-м розчином гідроксиду натрію):
S2- + Pb2+→ PbS↓
Реакція обумовлена наявністю в молекулі білка SH-груп, а також груп: –S – S – та – S – CH3. Дозволяє виявити в молекулі білка залишки амінокислот: цистеїну, цистину, метіоніну.
· реакція Мілона;
Розчин білка + реактив Мілона (розчин нітрату ртуті в суміші нітратної та нітритної кислот) + кип’ятіння → випадіння червоно-рожевого осаду.
Реакція зумовлена наявністю у молекулі білка залишків тирозину.
· реакція Адамкевича.
Розчин білка + гліоксилова кислота + сульфатна кислота (каталізатор) → виникає фіолетово-синє забарвлення.
Реакція свідчить, що в складі молекули білка є залишки триптофану.
Класифікація білків:
Ø За будовою молекули: глобулярні і фібрилярні;
Ø За складом молекул: прості (протеїни) і складні (протеїди);
Ø За розчинністю: у воді, солях, у кислотах;
Ø За фізичним станом: тверді, рідкі, напіврідкі;
Ø За харчовою цінністю: повноцінні, неповноцінні.
 |

| Модель карбоксипептидази (глобулярний білок, складний) | ||||

| Модель молекули інсуліну (глобулярний білок) | ||||

| Кератин (фібрилярний білок, простий) | ||||

| 
| ||||
| Потрійна спіраль колагену (фібрилярний білок, простий) | Фіброїн (фібрилярний білок, простий) | ||||
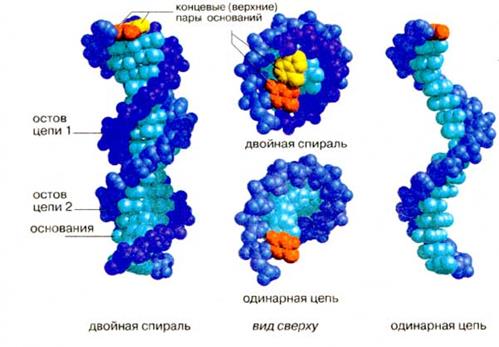
| Фрагмент ДНК | ||||

| Структура міоглобіну. Міоглобін – червоний залізовмісний пігмент. Складається з одного гему та однієї молекули глобіну. Депонує у м’язовій тканині кисень і передає його відповідним ферментним системам. Молекула складається із довгого спіралеподібного поліпептидного ланцюга, що містить 153 амінокислотних залишки і гему. Молекулярна маса міоглобіну – 17000. Він переносить до органів, тканин і клітин кисень і забирає вуглекислоту. | ||||
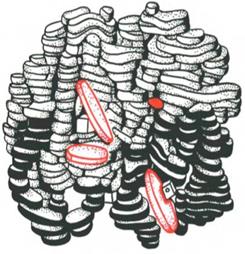
| Структура гемоглобіну (глобулярний білок, складний ‑ хромопротеїд). До складу молекули входять чотири субодиниці, кожна з яких складається з молекули простого білка глобіну і простетичної групи гему. Молекулярна маса однієї субодиниці 17000, молекули гемоглобіну – 64000. Молекула гемоглобіну складається з 574 амінокислотних залишків. Гемоглобін становить 94% сухої маси еритроцита. Кожен еритроцит містить у середньому 280млн. молекул гемоглобіну. Гемоглобін у складі еритроцитів транспортує кисень від легень до тканин і клітин всього організму, а вуглекислоти – до легень. |
| Гемоглобін | Приєднання молекули СО до гему |







