ЛАБОРАТОРНиЙ практикум
По дисципліні “Екологічна експертиза виробництва
продовольчих товарів”
для спеціальностей товарознавчого факультету: 8.050301 "Товарознавство та комерційна діяльність", 7.050302 "Товарознавство та експертиза в митній справі", 7.050303 “Експертиза товарів та послуг".
Харків 2004
Вступ
Сучасні екологічні дослідження мають комплексний характер, охоплюючи дослідження гірських порід (геологія), вивчення хімічного складу повітря, вод, ґрунтів, рослинного і тваринного світу (хімія), спостереження за живими організмами, їх функціонуванням на різних рівнях організації. Недаремно на межі наук спостерігаються найцікавіші явища, створюються нові науки Отже, екологічні дослідження об'єднують зусилля спеціалістів багатьох наук Дедалі більшого значення набувають математичні методи планування експерименту, створення моделі окремого процесу, обробка результатів дослідження, складання прогнозів
Екологічні дослідження включають спостереження в природі (за окремими видами живих організмів, відносинами між популяціями в екосистемі, впливом абіотичного чинника на функціонування угруповань рослин чи тварин тощо), лабораторні дослідження (аналіз повітря, води, вивчення активності ферментів, (спостереження за діяльністю мікроорганізмів), аналіз отриманої інформації та її математичну обробку, створення на цій підставі теорії чи передбачення наслідків
Особливістю і складністю екологічних експериментів є те, що світ надзвичайно складний, багатогранний і його компоненти пов'язані в єдине ціле численними зв'язками, тому лабораторні дослідження чи спостереження в природі дуже важко об'єднати, результати одних експериментів перенести на інший рівень.
Останнім часом найновіші досягнення хімії, біологи, фізики, математики та інших галузей науки і техніки до послуг екології Тому і досягнення цієї інтегральної науки дедалі глибші й цікавіші, вони дають змогу побачити цілісність світу, проникнути в його сутність, зрозуміти явища, передбачити наслідки того чи іншого процесу.
Часто проведення досліджень стану довкілля має глобальний характер, зокрема при веденні моніторингу (від лат "монітор" — той, що наглядає, нагадує, попереджає), вивченні стану озонової оболонки Землі, виявленні негативного впливу на природне середовище кислотних дощів, визначенні зон особливого забруднення Світового океану тощо.
Встановлення хімічного складу і фізичних властивостей елементів довкілля — повітря, води, ґрунтів — досить важке завдання і вимагає певних навичок Особливістю повітря є його надзвичайна рухливість, тому забрудник в атмосфері може дуже швидко розсіятися, змінити своє місцеперебування, вступити в хімічну взаємодію з компонентами атмосферного повітря чи іншими забрудниками. Це саме стосується і води, хоча вона менш рухливе середовище, ніж повітря Особливістю ґрунтів є їхня мозаїчність — на незначній території хімічний склад різних ділянок може значно відрізнятися за вмістом вологи, концентрацією біо-елементів, забрудників, кислотністю тощо.
Склад повітря, поверхневих вод та ґрунтів взаємно впливають одне на одне. Його формують живі організми, починаючи від найпростіших — мікроорганізмів — до вищих тварин Однак найбільший коригувальний вплив на стан довкілля чинить господарська діяльність людини Саме людина змінює довкілля до невпізнанності, будуючи житло, господарські об'єкти, транспортні артерії, видобуваючи корисні копалини та викидаючи й складуючи відходи виробництва.
Хімічний склад компонентів довкілля змінюється в часі та при зміні умов середовища температури, вологості, тиску, наявності певних речовин. Він залежить також від характеру рельєфу та його геологічної будови, особливостей і обсягів техногенного тиску, динаміки фізико-географічних умов Тому відбір проб (місце точок відбору, відстань між ними, обсяги зразків і особливості їх зберігання тощо) має велике значення для правильності встановлення складу природних об'єктів, прогнозування забруднення та його поширення, визначення можливості й швидкості процесів самоочищення повітря чи поверхневих природних вод, загрози фотохімічного смогу, під час розв'язання екологічних і народногосподарських завдань.
Від фізико-географічних умов довкілля, особливостей і обсягів його забруднення, пов'язаних з різними типами людської діяльності, залежить вибір методів екологічної оцінки території, об'єкта чи акваторії, час виконання, тривалість і детальність досліджень
1. ВИЗНАЧЕННЯ ЕКОЛОГІЧНОГО СТАНУ ПОВІТРЯ
Склад повітря та його кількість — один з найважливіших, життєво необхідних екологічних чинників, від яких залежать колообіги хімічних елементів, життєдіяльність живих організмів, функціонування всієї біосфери.
Забруднення атмосферного повітря, особливо в приземному шарі, аерозолями та газоподібними сполуками негативно впливає на здоров'я людей, рослинний і тваринний світ.
Контроль за станом атмосфери здійснюють контактними і дистанційними методами.
За контактних методів аналізу проби повітря відбирають переважно аспіраційним методом, пропускаючи повітря крізь поглинальну систему. Поглиначі, які при цьому використовують, можна розподілити на три групи:
• рідкі поглиначі (фізична або хімічна абсорбція) — розчини кислот, лугів, солей: аміак поглинають розчином сульфатної кислоти, оксиди сульфуру — лугом, отримані розчини можна аналізувати, здійснивши попереднє концентрування, видалення домішок (за потреби), їх використовують для поглинання речовин у вигляді газів.
• тверді поглиначі — гідрофільні неорганічні матеріали (силікагель та молекулярні сита), гідрофобні (активоване вугілля), синтетичні макропористі органічні матеріали, вони поглинають гази, рідкі аерозолі, для вилучення їх з пор твердого сорбента здійснюють термодесорбцію (через нагріту трубку пропускають гелій, азот, аргон) або проводять екстракцію гексаном, бензолом, етанолом тощо;
• фільтрувальні матеріали використовують для вловлювання твердих аерозолів, після аспірації їх розчиняють у розчинах кислот чи лугів і отримані розчини аналізують.
У практиці використовують механічні, теплові, магнітні, електричні, оптичні, хроматографічні, мас-спектральні газоаналізатори.
Крізь поглинальний розчин або сорбент за допомогою насоса чи звичайного медичного шприца прокачують газ, контролюючи об'єм поглинутої газової суміші і швидкість аспірації, яка не повинна перевищувати 1,5—2,0 дм3/хв для рідких поглинальних систем.
Якісний аналіз газових сумішей проводять органолептичним або індикаційним методом з використанням пористих сорбентів Органолептично (за запахом) можна виявити сірководень Н2S, оксид сульфуру (IV) — сірчистий ангідрид S02, оксид нітрогену (IV) — бурий газ NO2, бензол, хлор; за кольором — хлор, оксид нітрогену (IV) Індикаційним методом визначають озон (побуріння паперу, обробленого розчином КІ), гідрогенсульфур (почорніння паперу з нанесеним на нього шаром РЬ(NО3)2, аміак (червоний лакмусовий папірець синіє).
Дистанційними методами за допомогою зондів, авіації, космічних супутників визначають турбулентність потоків повітря, пилове забруднення, вміст вологи, концентрацію окремих забруднювальних речовин Так, наступного дня після аварії на Чорнобильській АЕС хмару радіоактивних аерозолів було виявлено над територією Західної Європи з японського супутника.
Вперше радіохвилі були використані для аналізу стану іоносфери (за відбиванням і заломленням хвиль), а в 1965 р було складено карту хмарового покриву майже над усією земною поверхнею
З метою встановлення ступеня забрудненості повітря кількома речовинами, що діють одночасно, використовують комплексний показник — індекс забрудненості атмосфери (ІЗА) Для цього нормовані на відповідні ГДК середні концентрації домішок приводять до концентрації SO2, і підсумовують. ІЗА показує, у скільки разів сумарне забруднення повітря перевищує ГДК SO2.
Для спостереження за станом повітря в містах з населенням до 1 млн. жителів встановлюють 2—5 стаціонарних постів, з населенням понад 1 млн: — більше 10: в центрі міста, в зоні відпочинку, поблизу пожвавлених автомагістралей, ТЕС, промислових підприємств.
На постах проводять спостереження за однією з програм:
• за повною — о 1, 7, 13, 19 год;
• за неповною — о 7, 9, 13 год;
• за скороченою — о 7 і 13 год;
• за добовою - один раз на добу.
У повітрі визначають вміст пилу та його гранулометричний склад, концентрацію води, оксидів сульфуру, нітрогену, карбону (IV), кислот; якщо аналізують газові викиди підприємств чи повітря поблизу них, то визначають і специфічні сполуки, характерні для нього (гідрогенсульфур, бензол, важкі метали тощо).
1.1. Визначення концентрації діоксиду нітрогену в атмосферному повітрі.
Обладнання і реактиви: конічні колби, бюретка, штатив, піпетки Мора,
склянка Дрекселя, 4%-й розчин йодиду калію, 0,001 моль/дм3 розчин тіосульфату натрію, 0,2 % розчин крохмалю.
Хід роботи
Діоксид азоту в якості сильного окислювача виділяє йод з нейтральних розчинів йодиду калію в ході реакції:
2 KJ + NO2 + H2O = J2 + NO + 2 KOH
Для відбору проб повітря складають таку систему: склянка Дрекселя з 100 мл 4 % розчину KJ та аспіраційного устаткування. Повітря протягують
через склянку Дрекселя з швидкістю 0,05 дм3 за хвилину до появи в склянці з розчином KJ жовтого кольору. Після цього розчин KJ переносять в колбу й титрують 0,001 моль/дм3 розчином тіосульфату натрію до ледь помітного жовтуватого відтінку. Після цього у розчин додають 5 мл 0,2 % розчину крохмалю й титрують до зникнення синього забарвлення. Розрахунок концентрації діоксиду азоту С виконують за формулою:
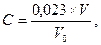 |
V – об’єм 0,001 моль/дм3 розчину тіосульфату натрію, мл;
V0 – об’єм проби повітря, дм3, приведений до нормальних умов;
0,023 – кількість NO2, мг, яка відповідає 1 мл 0,001 моль/дм3 розчину тіосульфату натрію.
1.2. Визначення концентрації пилу.
Обладнання і матеріали: сушильна шафа, щипці, аналітичні терези, беззольний паперовий фільтр, фільтроутримувач, ексикатор.
Хід роботи
Для визначення пилу використовують фільтрацію повітря крізь паперовий фільтр. Беззольний паперовий фільтр, попередньо висушений до постійної маси, вкладають у фільтроутримувач та сильно закручують. Перед відбором проби перевіряють герметичність патрону. Пробу відбирають зі швидкістю 25…100 дм3/хв. так, щоб вага пилу на фільтрі була не менше, ніж 4 мг. Після цього фільтр висушують до незмінної маси, зважують та розраховують концентрацію пилу за формулою:
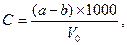 |
де: a – маса фільтра після відбору проби, мг;
b – маса фільтру до відбору проби, мг;
V0 – об’єм протянутого повітря, приведений до нормальних умов, л.
Контрольні запитання і завдання
1. Які речовини визначають у повітрі поблизу або на території підприємств?
2. Якими методами здійснюють контроль за станом повітря?
3. Які використовують поглиначі для відбору проб повітря?
2. ВИЗНАЧЕННЯ ЕКОЛОГІЧНОГО СТАНУ ВОДНИХ ОБ'ЄКТІВ
До водних об'єктів, які потребують екологічного вивчення, належать океани моря, річки, озера, штучні водойми, болота, підземні та стічні води
Вода — менш мінливе, ніж повітря, середовище Хімічний склад води, її фізичні характеристики, швидкість трансформації забрудників залежать від природних чинників
• хімічного складу ґрунту берегів і мулу,
• температури,
• багатства рослинного й тваринного світу водойми,
• швидкості течії,
• глибини водойми,
• рН води,
• вмісту розчиненого кисню та антропогенних забруднень, зокрема сусідства
• тваринницьких ферм, звалищ,
• сільськогосподарських угідь, на яких використовують різноманітні пестициди,
• промислових підприємств, енергетичних об'єктів,
• штучних водосховищ,
• місць скидання господарсько-побутових чи промислових стічних вод
Стабільність і трансформація хімічних сполук у воді залежать від наявності кількох забруднюючих речовин, які, взаємодіючи між собою, можуть утворювати як нетоксичні, так і більш токсичні, ніж вихідні, сполуки. Зокрема, сполуки меркурію за наявності органічних речовин здатні утворювати значно не безпечнішу для живих організмів сполуку — диметилмеркурій, хлор у надлишкових концентраціях хлорує органічні речовини до хлороформу та діоксанів.
Значною мірою впливають на хімічний стан водойм водонаповнення, скидання теплих вод, активізація різних мікробіологічних процесів.
Особливості відбору проб на аналіз
Місце відбору проб залежить від поставленого завдання Проби води відбирають у маловодні і багатоводні періоди.
Відбір проб може бути одноразовим (нерегулярним) або серійним (регулярним) Проба чи серія проб має бути характерною для місця відбору, а об'єм залежить від кількості визначуваних компонентів та обраної методики аналізу
Прості проби одержують одноразовим відбором об'єму води, необхідного для аналізу, змішані — це суміш простих проб, відібраних одночасно з різних місць досліджуваного об'єкта чи в одному місці через різні проміжки часу (вони характеризують склад води в просторі й часі) В окремих випадках, якщо стічні води скидаються у водойму, в якій аналізують воду, нерегулярно і в різних кількостях, відбирають середню пропорційну пробу (суміш простих проб, об'єм яких пропорційний кількості скинутих стічних вод)
Проби води відбирають у склянку з поліетилену чи боросилікатного скла. Посуд миють синтетичними мийними засобами, розчином хлоридної кислоти, скляний — хромовою сумішшю, після чого споліскують спочатку водопровідною, а потім дистильованою водою Перед відбором проб посуд 2—3 рази промивають водою, яку беруть для досліджень (для достовірності результатів відбирають одночасно по 2 проби)
Посудину заповнюють водою вщерть, щоб не залишалося повітря, і закривають пробкою Записують місце забору, час, прізвище особи, яка відбирала проби.
2.1. Визначення рН вод
Значення рН середовища має велике значення у формуванні хімічного складу вод, процесів їх очищення, забезпеченні умов існування для рослинного й тваринного світу водойми.. Зокрема, зниження рН сприяє підвищенню розчинності карбонатів, сульфідів, фосфатів важких металів, збільшенню їх міграції і доступності для засвоєння живими організмами, отруєнню.
Для більшості живих організмів водойм оптимальним є рН = 6,7—8,6 Цей показник залежить від багатьох чинників температури води, вмісту органічних речовин, діяльності живих організмів тощо.
Найзручніше і найточніше визначають рН вод з допомогою рН-метра Можна скористатися універсальним індикаторним папером і за кольоровою шкалою визначити рН Ще один спосіб — використання різних кислотно-основних індикаторів, які змінюють своє забарвлення при різних значеннях рН Знаючи інтервал рН зміни кольору кількох індикаторів, можна з достатньою точністю визначити рН води, наливши 5—10мл аналізованої води в пробірки і добавивши по 1—2 краплі індикатора. У табя. 2.1 наведені основні рН-індикатори, інтервали їх переходу та забарвлення
Таблиця 2.1 рН-ікдикатори
| Індикатор | Інтервал рН | Зміна кольору |
| Пікринова кислота | 0,1-1,3 | Безбарвний — жовтий |
| Кристалічний фіолетовий І | 0,13-0,5 | Жовтий — зелений |
| 1,0-1,5 | Зелений — синій | |
| III | 2,0-3,0 | Синій — фіолетовий |
| Крезоловий червоний І | 0,2-1,8 | Червоний — жовтий |
| II | 7,0-8,8 | Жовтий — пурпуровий |
| Метиловий жовтий | 2,9-4,0 | Червоний — оранжево-жовтий |
| Бромфеноловий синій | 3,0-4,6 | Жовтий — фіолетово-синій |
| Метиловий оранжевий | 3,0-4,4 | Червоний — оранжево-жовтий |
| 2,5-Динітрофенол | 4,0-5,8 | Безбарвний — жовтий |
| Метиловий червоний | 4,4-6,2 | Червоний — жовтий |
| Алізариновий червоний | 5,0-6,6 | Жовтий — фіолетово-червоний |
| Бромтимоловий синій | 6,0-7,5 | Жовтий — синій |
| Фенолфталеїн | 8,2-10,0 | Безбарвний - рожевий |
| Тимолфталеїн | 9,3-10,5 | Безбарвний — синій |
| Алізариновий жовтий К. | 10,0-12,0 | Жовтий — оранжево-червоний |
| Алізарин | 11,0-13,0 | Рожевий — фіолетовий |
| Фуксинова кислота | 12,0-14,0 | Яскраво-червоний — безбарвний |
2.2. Визначення кислотності та лужності води
Кислотність — це концентрація у воді речовин, що взаємодіють з сильними основами До них належать сильні кислоти, які у водному розчині повністю дисоціюють на іони (сульфатна, хлоридна, нітратна, хлорна), слабкі кислоти (ацетатна, сульфідна сульфітна, карбонатна) та катіони слабких основ, які у воді гідролізують з виділенням протонів (NН4, Fе 3+, А13+, катіони органічних основ).
Обладнання і реактиви: конічні колби, бюретка, штатив, піпетки Мора, тимолфталеїн або фенолфталеїн (0,1 %-й спиртовий розчин), метиловий жовтий (0,1 %-й розчин у 90%-му спирті), бромфеноловий синій (0,1%-й розчин у 20%-му спирті) або змішаний індикатор (0,1 г метилового оранжевого і 0,25 г індигокарміну розчиняють у 100 мл води), розчин NаОН, 0,1 моль/л
Під час визначення кислотності води, в якій містяться значні кількості феруму (II), додатково потрібен гексаметафосфат натрію (NаРОз)6, 2%-й розчин, нейтралізований за індикатором, який використовують при титруванні Якщо в розчині міститься активний хлор, його відновлюють пероксидом гідрогену
Хід роботи
Під час визначення кислотності титрування з різними індикаторами краще виконувати в окремих порціях аналізованої води
Визначення загальної кислотності До 50—100 мл аналізованої води добавляють 10 крапель розчину тимолфталеіну чи фенолфталеїну і титрують розчином NаОН на білому тлі до появи відповідно синього або рожевою забарвлення розчину, яке не зникає Якщо як індикатор застосовують фенолфталеїн (перехід забарвлення при рН = 8,2—10,0) чи тимолфталеїн (рН = 9,4—10,6), відбувається нейтралізація всіх кислот, зокрема й слабких
Визначення вмісту сильних кислот До іншої проби аналізованої води (100—50 мі) добавляють 5—6 крапель метилового жовтого (або індикатора, що його замінює) Пробу титрують розчином NаОН до зміни забарвлення розчину (у разі метилового жовтого інтервал рН переходу забарвлення 2,9—4,0) — від червоного до жовтою
Визначення вільної кислоти у водах з високою концентрацією Fе (II) Зв 'язування феруму (II) і феруму (III) гексаметафосфатом натрію. До відміряного об'єму аналізованої води що містить у 100 мл не більш як 120 мг іонів Fе (II) і не більш як 10 мг Fе (III), добавляють у дво - чи трикратному надлишку 2%-й розчин гексаметафосфату натрію, 5—6 крапель індикатора бромфенолового синього і титрують вільну кислоту розчином NаОН до появи жовто-зеленого забарвлення.
Залишають на 25—30 хв до зникнення жовтого відтінку, утворений зелений розчин знову титрують розчином Н2SО4 до переходу зеленого кольору в сірий. При правильному проведенні процесу на зворотне титрування витрачають не більш як 0,5 мл розчину сульфатної кислоти з концентрацією 0,1 моль/л
Кислотність воли Х визначають за формулою
X =А * K * 0,1 * 1000 / V, ммоль екв/л,
де А — об'єм розчину НС1, витраченого на титрування, мл, V' — об'єм води, взятої для аналізу, мл, К — поправковий коефіцієнт для розчину НС1 з С = 0,1 моль/л.
Лужність — це вміст у воді речовин, що здатні взаємодіяти з сильними кислотами Умовно їх можна поділити на три групи сильні основи (гідроксиди лужних і лужноземельних металів), слабкі основи (решта гідроксидів) та аніони слабких кислот (НСО3-, СО3,2--, Н2 РО4-, НРО 42-, S0 42-, аніони гумінових кислот, НS-, S2- тощо).
Визначенню перешкоджають інтенсивне забарвлення води (усувають добавлянням активованого вугілля з подальшим фільтруванням проби), вільний хлор, який знебарвлює індикатор (його видаляють, вводячи у воду еквівалентну кількість тіосульфату натрію з С = 0,1 моль/л), високий вміст вуглекислого газу (перешкоджає правильному визначенню переходу забарвлення індикатора при титруванні, його витісняють, пропускаючи крізь воду повітря).
Обладнання і реактиви: конічні колби місткістю 250 мл, піпетки Мора штатив, бюретка, розчин хлоридної або сульфатної кислоти С 0,1 моль/л, розчин NаОН,
С = 0 1 моль/л, індикатори метиловий жовтий (0,1%-й розчин в 90%-му спирті), або бромфеноловий синій (0,1%-й розчин в 20%-му спирті), чи змішаний індикатор (0,1 г метилового оранжевого і 0,25 г індигокарміну розчиняють у 100 мл води).
Хід роботи
Якщо стічна вола каламутна, її фільтрують, якщо інтенсивно забарвлена — розбавляють дистильованою водою у мірних колбах місткістю 100 чи 200 мл Взятий об'єм води враховують під час розрахунку результатів аналізу.
У конічну колбу наливають 100 мл аналізованої води, добавляють 5 крапель фенолфталеїну і отриманий розчин титрують на білому тлі хлоридною чи сульфатною кислотою до зникнення рожевого забарвлення Кількість витраченої кислоти відповідає лужності води за фенолфталеїном, тобто вмісту в ній речовин — слабких основ.
Потім у колбу добавляють 5—6 крапель метилового жовтого або бромфенолового синього чи змішаного індикатора В другу конічну колбу наливають такий самий об'єм аналізованої води і стільки ж індикатора, скільки його було добавлено в перший розчин Ставлять обидві колби на білий папір і титрують рідину в першій колбі доти, доки її колір не почне відрізнятися від кольору рідини в другій колбі Витрата титрованого розчину кислоти на друге титрування свідчить про вміст у воді аніонів слабких кислот
Загальний об'єм витраченої кислоти відповідає загальній лужності води Розрахунки виконують за формулою
А*К*100/V, ммоль екв/л,
де А — об'єм розчину кислоти, витрачений на титрування, мл, V — об'єм аналізованої води, мл, К — поправковий коефіцієнт для розчину кислоти С = 0,1 моль/л.
Контрольні запитання і завдання
1 Наведіть приклади впливу зниження рН на процеси у водних об'єктах
2 Чи впливає рН води на гідро біонтів?
3 Чому при підкисленні води спостерігається отруєння водяних організмів важкими металами
3. ВИЗНАЧЕННЯ ЕКОЛОГІЧНОГО СТАНУ ҐРУНТІВ.
У ґрунтовому моніторингу визначають вологість, вміст гумусу, обмінну здатність ґрунтового вбирного комплексу, рН, забруднення нітратами, пестицидами, нафтопродуктами, важкими металами, активність ґрунтової фауни, яка має надзвичайно важливе значення у формуванні ґрунту і забезпеченні його родючості.
Особливістю вивчення екологічного стану ґрунтів, на відміну від атмосфери і вод, є необхідність ранньої діагностики порушень засолення, закислення, забруднення, зміни структурно-механічних характеристик.
Для ґрунтів характерна зональність - сусідні ділянки можуть мати різний хімічний склад, що зумовлено рослинністю, глибиною залягання ґрунтових вод, материнською породою, освітленістю тощо Тому при аналізі ґрунтів відбирають середню пробу, що характеризує ґрунт на певній території.
Дистанційними методами користуються для отримання оперативних даних про температуру, вологість, засоленість, вміст гумусу у вертикальному розрізі ґрунту, товщину снігового покриву, стан рослинності.
З цією метою визначають діелектричну проникність та електропровідність, які залежать від типу вологості, хімічного складу ґрунту. Глибини проникнення електромагнітних хвиль з λ = ЗО м для піщаних сухих і вологих ґрунтів становлять відповідно 50 м і 1 м; при λ = 2,8-3,4 і 6-7 мкм спостерігається селективне поглинання хвиль молекулами води, тоді як при λ = 4—5 мкм воно зумовлене рослинним пігментом хлорофілом.
Радіоактивність, визначена аерометодами, характеризує тип ґрунту для чорноземних і каштанових ґрунтів вона вища, ніж для лісових і підзолистих; концентрація радіонуклідів зростає при збільшенні частки глинистої фракції
Інформація отримана дистанційними методами, дає змогу визначити не лише стан ґрунтів а й стан посівів біомасу, площу покриття ґрунтів рослинністю, полягання, захворюваність, пошкодження шкідниками, забур'яненість, ступінь розвитку рослин.
3.1. Гігроскопічна вода
1. Взяття зразків ґрунту і визначення його структури та складу
Оскільки ґрунт має різні будову і склад навіть на сусідніх ділянках, дуже важливим етапом аналізу є взяття зразків ґрунту, формування середньої проби, переведення її в повітряно-сухий стан, відбір певної за гранулометричним складом фракції.
Обладнання і матеріали: лопаточка, етикетки, поліетиленові пакети, фарфорова ступка, сито з отворами 1 мм, аналітичні терези, бюкси з притертою пробкою, сушильна шафа здатна давати температуру 100-150” С зразки ґрунту, дерев'яний шпатель.
Хід роботи
Лопаткою відбирають пробу по 100-200 г по кутках і в центрі ділянки, ґрунт якої аналізують. Вкладають проби в пакети, герметично їх зав'язують і зазначають на етикетці номер зразка ґрунту, дату і місце відбору.
Висипають проби на піддон рівним шаром видаляють сторонні домішки (листя, кору, грудки, коріння, сміття) Описують структуру ґрунту (розсипчастий, грудкуватий, кам’янистий тощо) та його склад (наявність і кількість сторонніх включень переважаючий тип) Залишають ґрунт для висихання.
Пробу повітряно-сухого ґрунту висипають на аркуш паперу і розрівнюють шаром в 1—2 см, налають форми прямокутника, ділять його на чотири прямокутники або чотири трикутники (рис. 4.1) і два з них відкидають, а два з'єднують, перемішують і знову зменшують пробу методом квартування до 300—500 г. Зважують ґрунт.
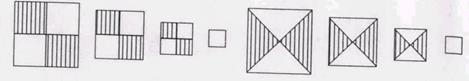
Рис. 3.1. Відбір проби ґрунту методом квартування
Порції фунту розтирають дерев'яним шпателем у фарфоровій ступці і просіюють крізь сито з отворами 1 мм. Частину ґрунту, що залишилася на ситі, зважують і визначають її вміст у відсотках віл загальної маси ("ґрунтовий скелет").
Грунт, який пройшов крізь сито, називають "дрібноземом" і використовують для аналізу.
3.2. Визначення вологості ґрунту
Вологість ґрунту зумовлена наявністю гігроскопічної води, що вбирається ґрунтом і видаляється з нього за температури 100—105° С. Висушування за цієї температури може давати завищені дані, що зумовлено видаленням з ґрунту газів і частково води, яка входить до складу кристалогідратів.
Вологість має велике значення для забезпечення родючості: у воді розчинені солі, необхідні для живлення рослин; ґрунтова волога зумовлює тургор рослин, завдяки процесам фільтрації, випаровування, розчинення відбувається міграція хімічних елементів у ґрунті.
Хід роботи
У бюксі з притертою пробкою зважують на аналітичних терезах з точністю до 0.0002 г приблизно 1—2 г проби повітряно-сухого ґрунту, вміщують відкритий бюкс у сушильну шафу і висушують пробу при 100—105° С 5 год. Бюкс виймають з шафи, закривають кришкою і ставлять в ексикатор на 20—30 хв. для охолодження, а потім зважують.
Масову частку гігроскопічної води відносно маси сухої проби визначають за формулою:
ω (Н 2 О)={т,- т,) *100/ ğ
де, т1 і m2 — маса бюкса з ґрунтом до і після висушування, г; ğ — маса проби після висушування, г.
Контрольні запитання і завдання
1. Як впливає вологість на процесії міграції хімічних елементів у ґрунті?
2. Назвіть антропогенні чинники, які змінюють структурно-механічні властивості грунту;як це впливає на родючість?
3.Як підготувати пробу грунту для аналізу?
3.2. Органічні речовини
У ґрунті, крім мінеральних, містяться й органічні речовини: розкладені і напіврозкладені мікроорганізмами рештки рослин і тварин, ґрунтовий гумус або перегній. Вміст гумусу в різних ґрунтах різний (у ґрунтах більшості типів не перевищує 5%, у чорноземах 8—10%, у болотних ґрунтах 18—20%) і зменшується від поверхні вглиб.
Вміст органічних речовин визначають за втратою маси ґрунту під час прожарювання (ВПП – втрата маси при прожарюванні), оскільки при 9000С органічні речовини згоряють з виділенням СО2, пари води та інших газоподібних продуктів, зокрема NО, NО2, S02. Однак за цієї температури з ґрунту видаляються, крім органічних речовин, ігроскопічна й кристалізаційна вода, карбонати тощо.
Обладнання і матеріали: муфельна піч, щипці, аналітичні терези, зразки ґрунту, фарфорові тиглі, ексикатор.
Хід роботи
Наважку повітряно-сухого ґрунту масою 1—2 г, зважену на аналітичних терезах у фарфоровому тиглі, ставлять у холодну муфельну піч і прожарюють при 900°С упродовж 1—1.5 год. Потім тигель охолоджують в ексикаторі і зважують. Повторне прожарювання проводять 15— 20 хв. до сталої маси тигля з пробою ґрунту. ВПП обчислюють за формулою:
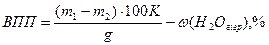
де m1 і m2, — маси тигля з наважкою повітряно-сухого ґрунту до і після прожарювання відповідно, г; ğ — маса наважки повітряно-сухого ґрунту, г; К — коефіцієнт перерахунку на сухий ґрунт, який визначають за формулою:
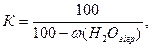
 де ω (Н20 гігр.) — масова частка гігроскопічної води, %.
де ω (Н20 гігр.) — масова частка гігроскопічної води, %.
Повторюють аналіз з іншими типами ґрунтів і порівнюють вміст органічних речовин у чорноземі, підзолистому ґрунті, сіроземі тощо.
Контрольні запитання і завдання
1. Які чинники впливають на вміст органічних речовин у грунті?
2. Який ґрунт (бідний чи багатий на органічні речовини) стійкий до розмивання дощовими водами? Чому?
4.3. Гідролітична кислотність ґрунту
Кислотність ґрунту має велике значення для росту й розвитку рослин, впливає на асиміляцію ґрунтовим обмінним комплексом катіонів важких металів та їх міграцію, доступність окремих поживних речовин для засвоєння рослинами тощо (табл. 3.1).
Так, при випаданні кислотних дощів знижується рН ґрунтового розчину, що може створити несприятливі умови для розвитку рослин; збільшується рухливість йонів металів, що містилися в фунті у вигляді малорозчинних солей слабких кислот (карбонати, фосфати, хлориди); зростає можливість накопичення рослинами катіонів важких металів і отруєння травоїдних, а потім хижих тварин і людини внаслідок акумуляції по ланцюгах живлення.
Розрізняють два види кислотності ґрунту: актуальну і потенційну. Актуальна кислотність визначається наявністю вільних йонів Н* у ґрунтовому розчині, її позначають як рН. Потенційна кислотність зумовлена наявністю Н* у грунтово-вбирному комплексі (ГВК) і позначається Н. Потенційну кислотність поділяють на обмінну і гідролітичну.
Обмінна кислотність зумовлена рухливими йонами Н*, які можуть бути витіснені з грунтово-вбирного комплексу катіонами нейтральних солей (NаС1, КСІ та ін.).
Таблиця 3.1. Оптимальні значення рН для основних сільськогосподарських культур
| Рослина | РН | Рослина | рН | Рослина | рН |
| Люпин | 4.5-6,0 | Льон | 5,9-6,5 | Яра пшениця | 6,3-7,6 |
| Гречка | 4,7-7,5 | Соняшник | 6,0-6,8 | Соя | 6,5-7,1 |
| Чай | 4.8-6,2 | Кукурудза | 6,0-7,0 | Бавовна | 6,5-9,0 |
| Картопля | 5,0-5,5 | Горох | 6,0-7,0 | Капуста | 6,7-7,1 |
| Овес | 5,0-7,7 | Конюшина | 6,0-7,0 | 6,8-7,5 | |
| Морква | 5,5-7,0 | Салат | 6,0-7,0 | Ячмінь | 6,8-7,5 |
| Редиска, ріпа | 5,5 і більше | Озима пшениця | 6,0-7,5 | Цукровий буряк | 7,0-7,5 |
| Просо | 5,5-7,5 | Огірки | 6.0-7,9 | Люцерна | 7.0-8,0 |
| Тимофіївка | 5,6 і більше | Томати | 6.3-6,7 | Коноплі | 7,1-7,4 |
Гідролітичну кислотність виявляють обробкою ґрунту розчинами солей сильної основи і слабкої кислоти (наприклад, ацетатом натрію СН3 СООNа).
Грунтово-вбирний комплекс з поглинутими катіонами(Н, Н, Са, Н, Мg) +
n СН3 СООNа ↔ Грунтово-вбирний комплекс з поглинутими катіонами(Nа, Nа) + ЗОН 3СООН + Са(СН 3СОО)2 + Мg(СН 3СОО)2 + (п - 7)СН 3СООNа.
При дії СН3СООNа на поглинальний комплекс відбувається активне витіснення йонів Н* з комплексу і нейтралізація активної кислотності грунту. Таким чином визначають сумарну кислотність (актуальну і потенційну). Йони Н що при цьому виділяються, утворюють СН3СООН, яку відтитровують розчином NаОН за наявності фенолфталеїну.
Обладнання і матеріали: зразки повітряно-сухого ґрунту, сито з отворами діаметром 1 мм, технічні терези, колба конічна з товстого скла (краще з притертою пробкою) місткістю 250—300 мл, ротатор (прилад для перемішування рідини обертальним рухом), мірна колба на 1000 мл, піпетки Мора на І і 50 мл. фільтрувальний папір ("синя стрічка"), рН-метр; розчин ацетату натрію, С = 0,1 моль/л (136 г СН3СООNа • ЗН20 розчиняють у дистильованій воді в мірній колбі на 1 л і доводять об'єм до риски (розчин повинен мати рН = 8,3...8,4); якщо розчин більш кислий, добавляють краплями 10%-й розчин гідроксиду натрію, якщо більш лужний — 10%-й розчин оцтової кислоти; розчин зберігають не більше трьох діб), 10%-й розчин МаОН; 10%-й розчин СН3 СООН; розчин NаОН, С = 0,1 моль/л; індикатор фенолфталеїн.
1. Титриметричний метод Хід роботи
Для аналізу беруть середню пробу ґрунту, висушують на повітрі, просівають крізь сито діаметром 1 мм. На технічних терезах зважують (з точністю до 0,01 г) наважку ґрунту і переносять її в колбу з товстого скла на 250—300 мл (краще з притертою пробкою). Потім у неї добавляють Імл розчину СН3СООNа. Суміш перемішують обертальним рухом, закривають колбу пробкою, вміщують на ротатор і збовтують упродовж 1 год.
Після цього суміш сильно струшують і фільтрують крізь сухий складчастий фільтр у суху колбу, намагаючись якомога більше перенести на фільтр ґрунту. Якщо фільтрат каламутний, першу порцію відкидають. Коли основна маса рідини буде відфільтрована, відбирають піпеткою 50 мл фільтрату і переносять у конічну колбу на 100—250 мл, добавляють 5—6 крапель фенолфталеїну і титрують розчином NаОН, С = 0,1 моль/л до появи рожевого забарвлення, яке не зникає упродовж 30—60 с.
Гідролітичну кислотність ґрунту Х виражають кількістю йонів Н що містяться в 100 г грунту:
Xk = V K*5*1,75 / 10, ммоль екв,
де V — об'єм розчину NаОН, С = 0,1 моль/л, витраченого на титрування; К— поправковий коефіцієнт для переведення розчину NаОН до концентрації 0,1 моль/л; 5 — коефіцієнт для перерахунку результату на 100 г ґрунту; 1,75 — коефіцієнт перерахунку (середня величина, яка показує середнє значення гідролітичної кислотності, оскільки при одноразовій обробці грунту СН3СООNа кислотність витісняється неповністю); 10 — поправка для переведення концентрації Н у ммоль екв.
Норми внесення вапна на гектар обчислюють за формулою:
VK * 5 * 50 * 1,75 *З * 106 * 10 /10 * 109, т/га
де V — об'єм розчину NаОН, витрачений на титрування 50 мл фільтрату; 10 — поправка для переведення мілілітрів розчину NаОН, С = 0,1 моль/л, у міліеквіваленти; 50 — поправка для переведення міліеквівалентів у міліграми СаСО3; 3 • 106 — коефіцієнт для переходу від 1 кг ґрунту до маси зораного шару на 1 га; 1 • 109 — коефіцієнт для переведення міліграмів СаСО3 в тонни, або:
Xвап = VK * 1,31.
рН-метричний метод (за Каппеном)
Метод ґрунтується на обробці ґрунту розчином ацетату натрію, С = 1 моль/л, при співвідношенні грунт: розчин = 1: 2,5 з наступним рН-метричним визначенням кислотності одержаної суспензії.
Хід роботи
Наважку ґрунту ЗО г заливають 75 мл розчину СН3СООNа (рН = 8,3...8,4). струшують упродовж 1 хв, відстоюють 18—20 год, повторно перемішують.
Перед початком роботи підлагоджують рН-метр за буферними розчинам рН=
4,01; 6,86; 9,18; під час виконання роботи справність приладу періодично контролюють за буферним розчином з рН = 6,86. Переносячи електроди з одного ґрунтового розчину в інший, їх споліскують дистильованою водою.
Обробка результатів
Гідролітичну кислотність ґрунту (в ммоль екв/100 г ґрунту) обчислюють за значенням рН, користуючись даними табл. 4.2.
| 1аблии,я 4.2. Коефіцієнти переведення рН ацетатної витяжки в одиниці гідролітичної кислотності | ||||||||||
| рН (цілі числа і десяті частки) | рН (соті частки) | |||||||||
| 0,00 | 0,01 | 0,02 | 0,03 | 0,04 | 0,05 | 0,06 | 0,07 | 0,08 | 0,09 | |
| Гідролітична кислотність, ммоль екв/100 г грунту | ||||||||||
| 6,0 | 17,3 | 16,9 | 16,6 | 16,2 | 15,8 | 15,5 | 15,2 | 14.9 | 14.5 | 14,2 |
| 6,1 | 13,8 | 13,6 | 13,3 | 13,1 | 12,5 | 12.2 | 12,0 | 12,0 | 11,7 | 11,5 |
| 6,2 | 11,2 | 11.0 | 10,8 | 10,5 | 10,3 | 10,1 | 9,84 | 9.64 | 9,44 | 9,23 |
| 6,3 | 9,04 | 8,83 | 8.65 | 8,45 | 8,25 | 8,11 | 7,92 | 7.76 | 7,59 | 7,41 |
| 6,4 | 7,28 | 7.11 | 6,97 | 6,81 | 6,69 | 6,53 | 6,38 | 6,26 | 6,11 | 5,98 |
| 6,5 | 5,85 | 5,73 | 5,61 | 5.48 | 5,37 | 5,25 | 5,14 | 5,03 | 4,92 | 4,82 |
| 6,6 | 4,71 | 4,61 | 4,52 | 4,42 | 4,32 | 4,23 | 4,14 | 4,05 | 3,96 | 3,82 |
| 6,7 | 3,79 | 3,71 | 3,56 | 3,48 | 3.40 | 3.33 | 3,26 | 3.19 | 3.13 | |
| 6,8 | 3,05 | 2,99 | 2,92 | 2,86 | 2,80 | 2,74 | 2,68 | 2,62 | 2,57 | 2,52 |
| 6.9 | 2,46 | 2,41 | 2,35 | 2,32 | 2.25 | 2,21 | 2,16 | 2,11 | 2,07 | 2,02 |
| 7,0 | 1,98 | 1,94 | 1,90 | 1,86 | 1,82 | 1,78 | 1,74 | 1,70 | 1,76 | 1,63 |
| 7,1 | 1,60 | 1,56 | 1.53 | 1,50 | 1,46 | 1,43 | 1,40 | 1,37 | 1,34 | 1,31 |
| 7,2 | 1,28 | 1.26 | 1,23 | 1.20 | 1,18 | 1,15 | 1,13 | 1,10 | 1,08 | 1,06 |
| 7,3 | 1,03 | 1.01 | 0.99 | 0,97 | 0,95 | 0,93 | 0,91 | 0,89 | 0,87 | 0,85 |
| 7.4 | 0,83 | 0.81 | 0,80 | 0,78 | 0,76 | 0,75 | 0,73 | 0,72 | 0.70 | 0,68 |
| 7,5 | 0,67 | 0,66 | 0,64 | 0,63 | 0,61 | 0.60 | 0,59 | 0,58 | 0,56 | 0,55 |
| 7,6 | 0,54 | 0,53 | 0,52 | 0,51 | 0,49 | 0,48 | 0,47 | 0,46 | 0,45 | 0,44 |
| 7.7 | 0,43 | 0,43 | 0.42 | 0.41 | 0,40 | 0,39 | 0,38 | 0,37 | 0,37 | 0,36 |
| 7,8 | 0,35 | 0 34 | 0,33 | 0,33 | 0,32 | 0,31 | 0,30 | 0,29 | 0,29 | 0,29 |
| 7,9 | 0,28 | 0,28 | 0,27 | 0,26 | 0,26 | 0,25 | 0,25 | 0,24 | 0,24 | 0,23 |
| 8,0 | <0,23 |
Контрольні запитання і завдання
І. Назвіть основні причини підвищення кислотності ґрунтів
2. Які рослини можуть вказати на рН ґрунту?
3. Яких меліоративних заходів вживають з метою зменшення кислотності
ґрунтів?
4.Визначення радіаційної чистоти продуктів харчування та природної сировини
Радіоактивність – властивість спонтанного перетворення із ядер атомів одних елементів у інші, яка супроводжується викидом іонізуючих випромінювань.
Радіоактивне випромінювання складається з трьої видів променів різної природи, які називаються α, β та γ – випромінювання.
α-випромінювання являє собою потік α-частинок (ядер атомів гелію – 4/2 Не), які несуть подвійний позитивний заряд і масу, що дорівнює 4 атомних одиницям і має кінетичну енергію порядку кількох мегелектронвольт.
β-випромінювання являє собою потік β-частинок, що мають таку ж масу й негативний заряд, як орбітальні електрони.
γ-випромінювання являє собою електромагнітне випромінювання з кількома дискретними частотами для різних γ-випромінювачів.
Джерелами α-, β-, і γ-випромінювань є ядра так званих природньо радіоактивних хімічних елементів, розташованих наприкінці таблиці Д.І. Менделеєва (атомна маса більша за 83). Всі ці елементи утворюються шляхом послідовних радіоактивних перетворень. Кінцевим елементом є стабільна речовина.
Різні радіоактивні атоми при розкладі виділяють різні види випромінювань. Атом, який випромінює α-частинки, вже не може випромінювати β-частинки, і навпаки. Кожний конкретний радіоактивний атом може мати тільки один характерний вид випромінювання. Розрізняють α- і (α+γ)-випромінювачі, β- і (β+γ)-випромінювачі та “чисті” γ-випромінювачі (тобто ті, які дають тільки γ-випромінювання).
Всі проникаючі випромінювання, проходячи крізь будь-яке середовище, поглинаються цим середовищем, спричиняючи в ньому первинні чисто фізичні зміни. Різні види випромінювань по-різному поглинаються, проходячи крізь матеріали. Окрім того, ступінь поглинання залежить також від виду матеріалу. В результаті взаємодії всіх видів іонізуючих випромінювань з речовиною в речовині утворюються іони. Відрізняються вони густиною іонізації: α-частини створюють в речовині велику густину іонізації β-частини і γ-випромінювання – значно меншу. Оскільки γ-кванти відносно слабо взаємодіють із речовиною, вони мають більшу проникаючу здатність.
В простих речовинах α-, β- і γ-випромінювання не визивають незворотних змін. У складних речовинах у результаті іонізації та збудження з’являються іони та радикали, що можуть утворювати нові молекули.
Тому в живому організмі під дією будь-якого виду іонізуючого випромінювання завжди відбуваються хімічні перетворення, які можуть призводити до цілого комплексу біохімічних змін у організмі.
В біосфері є велика кількість хімічних елементів у вигляді радіоактивних ізотопів, хімічні властивості яких однакові, наприклад: 39К, 40К. 12С, 14С та інші.
Тому радіоактивні ізотопи приймають участь у тих же реакціях обміну речовин у живих організмах, що й нерадіоактивні. Крім того, деякі радіоактивні ізотопи за хімічними властивостями подібно до нерадіоактивних ізотопів інших хімічних елементів. Наприклад, 90Sr подібний за властивостями до 40Са, 137Cs подібний до 39К. Це зумовлює їх локалізацію в тканинах.
Радіонукліди належать до екологічно небезпечних забруднень. Інформація про ступень радіаційної чистоти продуктів харчування дозволяє виключити або зменшити дози опромінювання організму людини шляхом невикористання продуктів, що містять радіонукліди.
Після аварії на ЧАЕС до біосфери надійшов ряд радіонуклідів. Основну небезпеку представляють довгоіснуючі ізотопи 137С і 90Sr, яким надається найбільша увага під час радіологічного контролю.
Для кількісної оцінки радіаційної чистоти продуктів харчування і сировини застосовується така одиниця виміру, як активність.
За допомогою радіометра “Бета”, або інших радіометрів, може бути проведене вимірювання активності з достатньою точністю.
Активність – це кількість розпадів на одиницю часу. При цьому враховується розпад всіх ізотопів, що містить досліджуваний продукт. В системі СІ одиницею вимірювання активності є беккерель (Бк).
1 Бк = 1 розпад за секунду,
позасистемною одиницею є кюрі (Ки).
1 Ки приблизно відповідає активності 1 г радію. Взаємозв’язок між вказаними одиницями вимірювання визначається співвідношенням:
1 Ки = 3,7 ´ 1010
в практичній роботі використовується об’ємна активність, яка вимірюється в одиницях Ки, або питома активність, яка вимірюється в одиницях Ки.кг. Крім того, активність може бути віднесена до одиниці площі: Км. м., Ки. га.
Дозиметричні прилади для контролю радіаційної чистоти продуктів призначено для вимірювання потоку β-частинок. За визначеною густотою потоку з урахуванням вказаного в паспорті приладу коефіцієнта можна підрахувати об’ємну активність для досліджувальної прби.
Регістрат “Бета” призначено для контролю забруднення води і продуктів харчування β-активними радіонуклідами, а також для контролю радіактивного забруднення різних поверхонь. Результати вимірювань радіометром, одержані населенням, не можуть бути використані для офіційних висновків про радіактивне забруднення об’єктів. Такі висновки видають тільки державні спеціалізовані служби.
Підготовка радіометра до роботи
1. Перед тим, як працювати з радіометром, потрібно вивчити принцип дії радіометра, його конструкцію та призначення органів управління.
2. Робота з радіометром проводиться в умовах, які відповідають до робочих умов експлуатації.
3. Радіометр повинен бути розміщений у світлому, опалювальному приміщенні.
4. Всі блоки, які входять до складу радіометра, повинні розміщуватися на одному робочому місці.
5. Відстань між будиночком свинцевим та блоком індикатора не повинна бути більше за 1 м.
6. Кювети, які входять до складу радіометра, перед вимірюванням треба ретельно промити, висушити, щоб не було залишків радіактивного забруднення.
7. Після тривалого зберігання радіометра перевіряють стан сухих елементів живлення, для чого потрібно відчинити кришку відсіку живлення, дістати елементи з відсіку та оглянути їх. Якщо відбулося окислення або сульфітація елементів, треба очистити їх та встановити у відсік, враховуючи полярність.
8. Якщо радіометр працює від мережі, необхідно блок підключати до радіометра через штатний роз’єм живлення.
Увага: якщо індикатор не засвічується або мерегтить при роботі від батарей, то батареї розрядилися.
Вимірювання радіаційної чистоти харчових продуктів із використанням будиночка свинцевого.
- підготувати радіометр до роботи з будиночком свинцевим, для чого на задній стінці будиночка відкрутити гайку кріплення, витягти ущільнювачі кабелю, відчинити дверцята будиночка свинцевого, протягти в отвір на задній стінці будиночка кабель блока детектора.
Встановити блок детектора в верхній паз корпусу будиночка свинцевого, ущільнити кабель у отворі вщільнювачами і зафіксувати гайкою кріплення. Підключити роз’єм кабелю блоку детектора до роз’єму блоку індикатора при включеному живленні індикаторів.
Під час проведення вимірювання в будиночку свинцевому захисні сітка та кришка не використовуються;
- до кювети налити дистильованої води або взяти чисту пусту кювету. Встановити кювету у нижній паз корпусу будиночка свинцевого. Встановити тривалість вимірювання t = 1000 с;
- натиснути кнопку “ПУСК”. коли час вимірювання вичерпано, прочитати кількість фонових імпульсів Nф і обчислити швидкість їх рахунку nф. При вводі радіометра в експлуатацію в новому приміщенні рівень фону визначається не менше 10 разів протягом дня, після цього обчислюється середнє значення результатів 10-ти вимірювань.
Проводити вимірювання фону необхідно за 2 години роботи. Якщо за результатами останнього вимірювання рівень фону збільшився більш як на 50% у порівнянні за попереднім, то внутряшня та зовнішня поверхні будиночка свинцевого, вимірювальні кювети треба дезактивувати. Свинцевий будиночок і кювети промити мильним розчином. Зовнішні поверхні блока детектора протерти етиловим спиртом, при цьому необхідно не доторкуватися до поверхні робочого вікна;
- підготувати проби до вимірювання. Проби харчових продуктів піддають обробці, ідентично тій, яка застосовується на першому етапі приготування їжі.
Корнеплоди та картоплю очищають від грунту, промиваючі у проточній воді. З капусти знімають неїстінне листя. Їстівну зелень, ягоди та фрукти промивають у проточній воді. М’ясо й рибу миють, рибу очищують від луски, видаляють внутрішність. Із ковбасних виробів знімають оболонку, з сиру – шар парафіну.
Підготовлені продукти подрібнюють за допомогою м’ясорубки, тертешки, мличка для кави і. т. ін. Їстівну зелень, траву, сіно подрябнюють ножиком в емальованій кюветі.
Подрібнений продукт за допомогою шпателя чи ложки складають у кювету й ущільнюють. Надлишок з поверхні прибирають до сдержання поверхні продукта, розміщеного на одноому рівні з верхніми краями кювети.
При дослідженні рідких або пастоподібних продуктів кювету повністю заповнюють пробою, яку контролюють;
- розмістити в нижньому пазу корпусу будиночка свинцевого кювету з пробою. Встановити тривалість вимірювання t = 1000 с (п’ятий режим);
- написнути кнопку “ПУСК”. Коли термін вимірювання вичерпано, прочитати на цифровому табло індикатора кількість відрахунків N. Обчислити швидкість рахунку n.
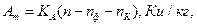
Питома активність одиниці маси продукту
де Аm – питома активність одиниці маси, Ки/кг,
Аm – відношення активності радіонукліда в зразку проби до маси зразка;
КА – градуювальний коефіцієнт. Який зв’язує швидкість рахунку з питомою активністю Аm, част.р.; Ки/кг.
Значення КА вибирається в залежності від речовини, яка контролюється згідно з таблицею 1.2.
n – загальна швидкість рахунку (бета-частинки + фон + бета-частинки) від природного радіонукліда 40К част. р./с;
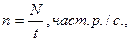 |
nф – означає кількість відрахунків, які реєструються на цифровому табло індикатора за с.; визначається за формулою:
де N – кількість відрахунків (імпульсів) зареєстрованих протягом терміну вимірювання, част.р.;
t – тривалість вимірювання, згідно з обраним режимом роботи, с (табл. 1).;
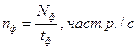 |
nф – швидкість рахунку фону, част. р./с., визначається за формулою:
nк – швидкість рахунку від природного радіонукліда 40К (значення обирається з табл. 1.3).
Приклад обробки результату вимірювання активності маси продукту.
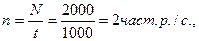 |
Вимірювання активності манної крупи проводили на режимі t = 1000 с, N = 2000 част. р.
Вимірювання фону (пустої кювети або кювети з дистильованою водою) – на цьому ж режимі.
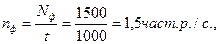 |
Nф = 1500 част. р.
Перевірка вірності вибору режиму:
N – Nф = 2000 – 1500 = 500 част. р.
Для N – Nф = 500 част. р. рекомендується 5-й режим (табл. 1.4)
Аm = 5,26 ´ 10-8(2 – 1,5 – 0,04) = 5,26 ´ 10-8 ´ 0,46 ´ 2,42 ´ 10-8 Ки/кг.
Порівнюємо результат з допустимим рівнем (табл. 1.4). допустимий рівень для манної крупи (круп) складає 1 ´ 10-8 Ки/кг.
ВИСНОВОК: забрудненість манної крупи β-випромінюючими радіонуклідами вища за допустимий рівень.
Таблиця 1.1
РЕЖИМИ ВИПРОМІНЮВАННЯ
| Значення різниці N-Nф при t = 1000 с | Рекомендована тривалість випромінювання t, с |
| N-Nф ≥ 500 | t = 100 |
| 500 ≥ N-Nф ≥ 250 | t = 2000 |
| 250 ≥ N-Nф ≥ 100 | дворкатне вимірювання при t = 2000 с |
| 100 ≥ N-Nф ≥ 0 | кратність вимірювання встановлюється в залежності від потрібної точності вимірювання згідно з поясненнями |
ПОЯСНЕННЯ: Відносна статистична похибка η вимірювання різниць величини N – Nф оцінюється за формулою:
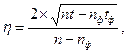 |
де t, tф – відповідно, тривалість вимірювання проби та фону, с.
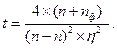 |
Якщо t = tф, то тривалість вимірювання заданої статистичної похибки η можна оцінити за формулою:
Таблиця 1.2
ЗНАЧЕНЯЯ КОЄФІЦІЄНТА КА
| Речовина, яку контролюють | КА, Ки/кг (Ки ´ кг-1) |
| Молоко, та молочні продукти, корнеплоди, бобові | 8,35 ´ 10-8 |
| Істівна зелень, круп’яні продукти, зерно | 5,26 ´ 10-8 |
| Вода питна (водопровідна) | 8,36 ´ 10-8 |
Таблиця 1.3
ЗНАЧЕННЯ ШВИДКОСТІ РАХУНКУ ВІД ПРИРОДНОГО РАДІОНУКЛІДА 40К
| № з/п | Продукт | Вміст 40К´г/кг | Питома активність 40К´10-9 Ки/кг | Швидкість nК, 1 с |
| 1. | Молоко та дитячі молочні суміші, кефір | 1,50 | 1,20 | 0,05 |
| 2. | Буряк | 2,9 | 2,32 | 0,095 |
| 3. | Зелень | 5,0 | 4,0 | 0,16 |
| 4. | Хліб пшеничний | 1,85 | 1,48 | 0,06 |
| 5. | Крупи: манна пшоно горох лущений | 0,92 2,0 7,3 | 0,96 1,6 5,84 | 0,04 0,065 0,24 |
| 6. | Зернові: ячмінь | 4,55 | 3,64 | 0,15 |
| 7. | Зернобобові: горох | 8,75 | 7,0 | 0,29 |
Контрольні запитання і завдання
1. Назвіть основні радіонукліди – забруднювачі продовольчої сировини та харчових продуктів?
2. Яка одиниця виміру застосовується для кількісної оцінки радіаційної чистоти продуктів харчування і сировини?
3. Які радіоактивні ізотопи за хімічними властивостями подібніо до нерадіоактивних ізотопів?
5. РОЗРАХУНКИ ЕКОНОМІЧНИХ ЗБИТКІВ ВІД ЗАБРУДНЕННЯ ДОВКІЛЛЯ
5.1. Визначення плати за викид шкідливих речовин в атмосферу стаціонарними джерелами
1. Сумаплати за нормований викид шкідливих речовин в атмосферу
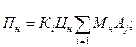 |
Для підприємств, що мають встановлені норми гранично допустимих викидів (ГДВ) або тимчасово узгоджених викидів (ТУВ), суму платежів за нормований викид шкідливих речовин в атмосферу визначають за формулою
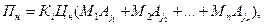 |
де Пн — сума платежів за нормований викид, гри, Кі — показник відносної екологічної небезпечності підприємства, Цн — ставка платежів за нормативно допустимий викид (у м Сімферополі вона дорівнює орієнтовно 75 грн за умовну тонну), Мн — нормативне допустима маса валових викидів j-ї домішки (у межах, встановлених ГДВ і ТУВ), т/рік, Аj — показник відносної агресивності j-ї домішки, п — кількість шкідливих речовин, що викидається підприємством в атмосферу.
Схема розрахунку плати наведена в табл. 5.1.
Таблиця 5.1. Схема розрахунку плати за фактичний викид, який не перевищує ГДВ забруднюючих речовин в атмосферу
| Домішки | Показ-ник віднос-ної еколо-гічної небез-печності підпри-ємства Кі | Показ-ник від-носної агресив-ності j-ї домішки Аj | Нормований викид | |
| Встанов-лена норма викиду, т/рік | Фактич-ний викид Мн, т/рік | Зведена маса умовн. т/рік гр.3*гр.5 | Ставка плате-жів, Цн, грн./ умов.т | Сума плате-жів, грн. гр.2*гр.6*гр.7 Пн |
| Пил деревний | 2,79 | 0,95 |






