Лабораторная работа № 3
Кондуктометрическое титрование
Определение содержания NaОН и Na2CO3 при их совместном присутствии
ВНИМАНИЕ! Прежде чем приступить к выполнению работы, необходимо убедиться, что приборы и магнитная мешалка заземлены, а электропроводка исправна.
Метод основан на измерении электропроводности в процессе титрования NaОН и Na2CO3 соляной кислотой. По изменении электропроводности в зависимости от объема титранта строят кривую титрования, изломы на которой будут соответствовать точкам эквивалентности.
Аппаратура, материалы и реактивы
· кондуктометр любой марки;
· электролитическая ячейка с платиновыми электродами;
· мешалка магнитная;
· бюретка вместимостью 25 мл;
· колба мерная вместимостью 100 мл;
· пипетка вместимостью 10 мл;
· стандартный раствор соляной кислоты, 0,1 н.
Выполнение анализа
Включают кондуктометр и настраивают его согласно инструкции.
Исследуемый раствор(задача) может содержать смесь соды и щелочи. Пипеткой переносят аликвотную часть анализируемого раствора в кондуктометрическую ячейку (стеклянный стакан на 150 мл), опускают в нее электрод, следя за тем, чтобы он был погружен в раствор. При необходимости добавляют немного дистиллированной воды, чтобы закрыть поверхность электрода исследуемым раствором. Включают мешалку.
Титруют анализируемый раствор, приливая титрант по 1,0 мл. После добавления каждой порции титранта записывают объем титранта и соответствующее ему значение электропроводности.
Результаты кондуктометрического титрования вносят в таблицу и строят кривые титрования:
| Vт, мл | æ, мСм | ∆ æ | ∆V | ∆ æ ∕∆V |
| ….. | ||||
Титрование продолжают до тех пор, пока на кривой титрования не обнаружат изломы, соответствующие точкам эквивалентности. После этого приливают еще 3-4 порции титранта и заканчивают титрование. Подтверждением конца титрования является постоянный рост значений электропроводности после точки эквивалентности.
По окончании работы выключают прибор и мешалку, Отработанный раствор из ячейки выливают в раковину.
По полученным данным строят кривую титрования зависимости электропроводности раствора от объема прибавленного титранта, на которой находят значение объема в точке эквивалентности.
Зная значение объема титранта в точке эквивалентности и его концентрацию, по закону эквивалентов рассчитывают содержание соды и щелочи в анализируемом растворе.
При титровании наблюдаются две точки эквивалентности: первая, когда полностью нейтрализован NaОН и «наполовину» Na2CO3 и вторая, когда нейтрализуется NaНCO3. В этот момент наступает полная нейтрализация смеси NaОН и Na2CO3.
NaОН + Na2CO3 + 2HCl ® 2NaCl + NaHCO3 (фенолфталеин)
NaHCO3 + HCl ® NaCl + H2O + CO2 (метиловый оранжевый)
Расчетная часть
Содержание карбоната натрия и гидроксида натрия определяют по формулам:

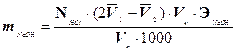
где N HCl - нормальность раствора соляной кислоты;
 - эквивалентные массы гидроксида натрия и карбоната натрия;
- эквивалентные массы гидроксида натрия и карбоната натрия;
V к и V п - объемы соответственно мерной колбы и мерной пипетки, мл.
V 1 и V 2 - объемы соответственно 1 и 2 точки эквивалентности, мл.






