Кислотний дощ утворюється в результаті реакції між водою і такими забруднюючими речовинами, як діоксид сірки (SО2) і різних оксидів азоту (NOx). Ці речовини викидаються в атмосферу автомобільним транспортом, у результаті діяльності металургійних підприємств і електростанцій, а також при спалюванні вугілля і деревини. Вступаючи в реакцію з водою атмосфери, вони перетворюються в розчини кислот - сірчаної, сірчистої, азотистої й азотний. Потім, разом із снігом чи дощем, вони випадають на землю.
Природними джерелами надходження діоксиду сірки в атмосферу є головним чином вулкани і лісові пожежі.
Природні надходження в атмосферу оксидів азоту зв'язані головним чином з електричними розрядами, при яких утвориться NО, згодом - NO2. Значна частина оксидів азоту природного походження переробляється в ґрунті мікроорганізмами, тобто включена в біохімічний круговорот.

Джерела викидів в атмосферу оксидів сірі (a) і азоту (б)
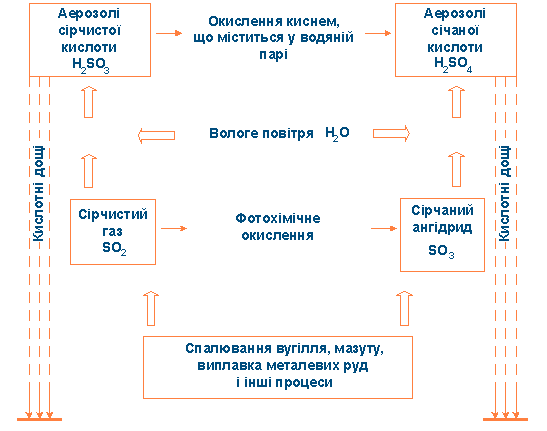
Схема утворення кислотних аерозолів і дощів
Діоксид сірки, що потрапив в атмосферу, перетерплює ряд хімічних перетворень, що ведуть до утворення кислот.
Частково діоксид сірки в результаті фотохімічного окислювання перетворюється в триоксид сірки (сірчаний ангідрид) SО3:
2SO2 + О2 → 2SO3
який реагує з водяною парою атмосфери, утворюючи аерозолі сарною кислоти:
SО3 + Н2О → H2SО4
Основна частина діоксиду сірки, що викидається у вологому повітрі утворить аерозоль сірчистої кислоти і зображують умовною формулою Н2SO3:
SO2 + H2O → H2SO3
Сірчиста кислота у вологому повітрі поступово окисляється до сірчаної:
2H2SO3 + O2 → 2H2SO4
Аерозолі сірчаної і сірчистої кислот приводять до конденсації водяної пари атмосфери і стають причиною кислотних опадів (дощі, тумани, сніг). При спалюванні палива утворяться тверді мікрочастинки сульфатів металів (в основному при спалюванні вугілля), легко розчинні у воді, що осаджуються на ґрунт і рослини, роблячи кислотними роси.
Аерозолі сірчаної і сірчистої кислот складають близько 2/3 кислотних опадів, інше приходиться на частку аерозолів азотної й азотистої кислот, що утворяться при взаємодії діоксиду азоту з водяною парою атмосфери:
2NО2 + H2О → НNО3 + HNO2
Існують ще два види кислотних дощів, що поки не відслідковуються моніторингом атмосфери. Хлор, що знаходиться в атмосфері, при з'єднанні з метаном (джерела надходження метану в атмосферу: антропогенний - рисові поля, а також результат танення гідрату метану у вічній мерзлоті внаслідок потеплення клімату) утворить хлороводень, що добре розчиняється у воді з утворенням аерозолей соляної кислоти:
Сl + СН4 → СH3 + HCI, СН3 + Cl2 → СН3Сl + Сl
Джерела кислото-створюючих викидів: теплові електростанції, автотранспорт, металургійні і хімічні прежпріятія, авіація
Об'єкти поразки: люди, тваринний і рослинний світ, водоймища, грунт, будівлі, пам'ятники культури, вироби з металу
Наслідки кислотних опадів






